 HOME | ÍNDICE POR TÍTULO | NORMAS PUBLICACIÓN
HOME | ÍNDICE POR TÍTULO | NORMAS PUBLICACIÓN Espacios. Vol. 37 (Nº 06) Año 2016. Pág. 9
Mariane C. de SOUZA 1; André L. KORZENOWSKI 2; Filipe A. de MEDEIROS 3; Carla S. ten CATEN 4; Rafael HERZER 5
Recibido: 13/10/15 • Aprobado: 28/11/2015
RESUMO: Os laboratórios de análises clínicas no Brasil, devido a um novo regulamento, são obrigados a implementar indicadores do Programa Qualiss. Conforme encontrado na literatura os padrões ISO 9001, ISO 17025 e ISO 15189 devem ser seguido nestes processos de implementação. Uma revisão da literatura não evidênciou estudos que fornecem uma análise crítica destas normas. A contribuição é fornecer principais diferenças e semelhanças. Os resultados apontam que, com a certificação ISO 9001, os requisitos da norma ISO 17025 e ISO 15189 não são atendidos e demonstram que a norma ISO 15189 é que melhor atende as demandas solicitadas pelo Programa. |
ABSTRACT: Clinical analysis laboratories in Brazil, due a new regulation, are required to implement indicators from the Qualiss Program. As found in the literature ISO 9001, ISO 17025 and ISO 15189 are to be followed in these implementation processes. A literature review did not find a study that provides a critical analysis of these standards. The contribution of this paper is to provide the main differences and similarities. Results show that for a company with ISO 9001 certification, requirements for the ISO 17025 and ISO 15189 are not attended and demonstrate that the standard ISO 15189 is the one that best meets the demands requested by the National Health Agency. |
Na área da saúde, a medicina laboratorial pode ser considerada o setor pioneiro da área médica a promover e introduzir os conceitos da qualidade. Nos anos 1990, houve um consenso sobre os objetivos da qualidade e suas especificações no ambiente do laboratório clínico. Foram definidos os conceitos de controle da qualidade, garantia da qualidade e gestão da qualidade total neste ambiente (VIEIRA et al., 2010). Um Sistema de Gestão da Qualidade têm como objetivo fornecer uma base sólida para a qualidade nos laboratórios, contribuindo para ações preventivas (ALLEN, 2013).
Para o setor da saúde, a filosofia da qualidade não difere da aplicada em indústrias. A adequação do produto ou serviço aos anseios do cliente é um fundamento de qualidade perfeitamente aplicável aos diversos serviços de assistência a saúde (DOMINGUES, 2013). Com o aumento na dificuldade dos serviços de saúde e do aumento da expectativa de vida além do maior número de pacientes portadores de doenças crônicas, os gastos em saúde estão sendo onerados de modo que o desafio atual desse setor é prestar atendimento humanizado, com alta produtividade e baixo custo (BITTAR, 2004; PLEBANI, 2003). O setor da saúde exige que as entidades prestadoras de serviços disponham de um modelo de gestão que favoreça a melhoria contínua, qualidade, segurança, eficiência dos processos e que seja auditável e transparente (ANAHP, 2014).
Considerando a área de serviços, os laboratórios clínicos são empresas de serviços na área da saúde, classificados como meio auxiliar do diagnóstico médico, e apresentam aspectos comuns e similares as outras áreas (BECKER, 2004). Segundo Plebani (2003), a busca pela acreditação é primordial para a melhoria dos serviços laboratoriais, bem como a necessidade de um consenso internacional. As normas descrevem os requisitos de um sistema de gestão para alcançar a satisfação do cliente e alcançar a melhoria contínua na eficácia do sistema (SUMAEDI; YARMEN, 2015; NASCIMENTO et al., 2013; KARAPETROVIC, 2003; HOBDAY et al.,2005; SIMON et al., 2012 a, b). Os benefícios com a implantação da norma ABNT NBR ISO 9001 é uma maior agilidade para a organização, maior conhecimento do processo, melhor aplicabilidade e menores custos (NASCIMENTO et al., 2013; KARAPETROVIC, 2003; MIGUEL et al., 2012; SAMPAIO; SARAIVA; DOMINGUES, 2012; SAMPAIO; SARAIVA, 2011; DOMINGUES, 2013).
Segundo Valls (2005), a organização certificada simplifica seu sistema e passa a ter conhecimento de seu processo. A implementação de um sistema de qualidade ISO existe para permitir gerenciamento adequado da organização, enfatizando que se a estrutura for bem construída o sucesso é muito provável. A justificativa para implantar um Sistema de Gestão da Qualidade em serviços é o aumento do grau de satisfação do cliente e a busca pela competitividade, refletido pela busca de redução de custos, atendimento às exigências dos clientes e diferenciação da empresa e de seus serviços (MOONSAMY; SINGH, 2014; BECKER, 2004; VALLS, 2005).
As instituições de saúde, inevitavelmente, devem trilhar rumo a possuírem algum tipo de certificação concedida por entidades avaliadoras, como a melhoria da qualidade na assistência prestada ao cliente e manutenção dos padrões de excelência no atendimento que visem satisfazer às expectativas dos usuários (LIMA; ANGELO; DEMARCHI, 2013). O processo de certificação no contexto da saúde é importante para assegurar, garantir a eficácia e avaliação de planos, programas e sistemas relacionados com a qualidade. Outro aspecto relavante, é a referência aos consumidores de que o produto/serviço atende aos padrões mínimos de qualidade (ROSENBERG, 2000).
No cenário brasileiro o número de laboratórios clínicos públicos e privados, é descrito como a Tabela 1.
Tabela 1 – Laboratórios clínicos no Brasil e Rio Grande do Sul
Laboratórios Clinicos |
Brasil |
Rio Grande do Sul |
Público (SUS) |
4.917 |
128 |
Privado |
11.740 |
1.013 |
Público (SUS)/Privado |
5.468 |
677 |
Total |
16.657 |
1.141 |
Fonte: IBGE, 2010
O laboratório de análises clínicas em todo o processo deve oferecer ao paciente atendimento apropriado além de promover a excelência (GUZEL; GUNER, 2009), sendo que os resultados laboratoriais influenciam nos diagnósticos médicos em torno de 70%, ou seja, a qualidade deste serviço afeta diretamente a decisão médica e a tomada de condutas terapêuticas (BECKER, 2004; WESTGARD; DARCI, 2004).
O setor da saúde não dispõe de um Sistema de Certificação capaz de garantir a necessária segurança e qualidade (ROSENBERG, 2000). Com isso, a Agência Nacional de Saúde Suplementar (ANS), um órgão de regulação brasileiro, estabeleceu critérios para avaliar a qualidade de serviços prestados pelos laboratório de análises brasileiros e desenvolveu o Programa de Qualificação de Prestadores de Serviços de Saúde – QUALISS. Por tratar-se de um sistema novo, as empresas estão buscando formas de adaptar-se a esta realidade a partir de sistemas já consolidados em outras áreas, como a indústria. Especialistas em acreditação e gestores de laboratórios entrevistados apontaram que entre os padrões estabelecidos pela ISO, as normas ABNT NBR ISO 9001, ABNT NBR ISO/IEC 17025 e ABNT NBR NM ISO 15189 atendem, mesmo que parcialmente, aos requisitos estabelecidos pela ANS. Entretanto, entender como estas normas se complementam e onde elas se sobrepõe contitui a principal contribuição deste trabalho. Entender as similaridades e diferenças entre as normas regulamentadoras representa um auxílio para a tomada de decisão na implementação de um sistema de gestão integrado que atenda aos requisitos definidos pela agência, pelos órgãos reguladores e pelos clientes. Assim, o objetivo desta pesquisa é identificar as diferenças e similaridades entre os padrões.
Este trabalho caracteriza-se por uma abordagem qualitativa e exploratória. O trabalho foi desenvolvido em quatro etapas a saber: construção do referêncial, identificação dos requisitos, análise dos requisitos das normas e análise de similaridades e diferenças.
A primeira etapa deste trabalho foi caracterizado por uma busca pela construção do referencial, com foco nas normas de gestão ABNT NBR ISO 9001, ABNT NBR ISO/IEC 17025 e ABNT NBR NM ISO 15189. A pesquisa bibliométrica foi realizada considerando o periódico, ano de publicação, autores, palavras-chave e resumo. Foram coletados artigos publicados na base de dados do ScienceDirect através das palavras chave: "norma ISO 9001 no setor da saúde", "norma ISO 17025 no setor da saúde" e "ISO 15189 no setor da saúde" contidas em todo o texto. Entre os periódicos mais relevantes destacam-se Journal of Cleaner Production, Journal Science of The Total Environment, Journal Clinical Biochemistry, com 15, 14 e 11 artigos respectivamente. A Tabela 2 apresenta uma síntese das referências encontradas de cada norma, salienta-se que mesmo destacando que a busca é para o setor da saúde, foram evidenciados estudos na indústria.
Tabela 2 - Número de referências encontradas de cada norma
Normas |
Artigos encontradoss |
ISO 9001 |
187 |
ISO 17025 |
142 |
ISO 15189 |
83 |
Na segunda etapa, buscou identificar os requisitos de gestão e técnicos de cada norma, apresentando e caracterizando os requisitos similares e diferentes. A terceira etapa, foi definida como a tabulação dos requisitos através de uma planilha, evidenciando a norma ABNT NBR NM ISO 15189 como sendo a mais robusta e completa no que tange os requisitos de gestão e técnicos. Por fim, na quarta etapa foram encontradas as similaridades e diferenças com o auxílio da planilha construída.
As normas apresentam requisitos técnicos e de gestão que auxiliam a melhoria de processos internos. A ISO é uma rede de institutos de normatização nacionais representando 161 países membros. É uma organização sem fins lucrativos, cujo objetivo é produzir normas técnicas que agreguem valor para todos os tipos de negócios (ISO, 2010). As subseções 3.1 a 3.3 apresentam dados relevantes acerca das normas ABNT NBR ISO 9001, ABNT NBR ISO/IEC 17025 e ABNT NBR NM ISO 15189, respectivamente.
A Norma ISO 9001 promove a adoção de uma abordagem de processo para implantação e aperfeiçoamento da eficácia de um Sistema de Gestão da Qualidade. Gerenciar suas atividades e identificar atividades interligadas são requisitos fundamentais na implantação da norma para as organizações atuarem de maneira eficaz. (ABNT, 2000). A norma ABNT NBR ISO 9001 atende todas as partes de um sistema de gestão de qualidade (WADSWORTH, 2001), estabelece requisitos genéricos e se pretende que sejam aplicáveis a todas as organizações, não levando em conta seu tamanho, tipo ou produtos por elas fornecido (VALLS, 2005).
A ABNT NBR ISO 9001 está entre os padrões mais conhecidos publicados pela Organização Internacional de Normalização e têm sido implementada por milhares de organizações em 175 países. Algumas outras organizações poderiam se beneficiar da implementação de normas de sistema de gestão, mas não têm certeza quanto à viabilidade e efetivo resultado quanto à sua implantação (LEVINE; TOFFEL, 2010). Para Nascimento (2012), a demanda dos clientes e a influência exercida pelos concorrentes que implementaram um Sistema de Gestão da Qualidade pode ser outra fator motivador para a certificação na norma.
Para Kobs (2006), o gerenciamento através da norma, permite maior qualidade e economiza dinheiro, podendo ser utilizada por organizações orientadas a serviços e também para orientada para os produtos à alcançar padrões de qualidade. Aumentando a disposição dos clientes a pagar por qualidade, o que cria um incentivo para os gestores a investir na melhoria do produto ou qualidade do serviço (LEVINE; TOFFEL, 2010). Entre as pesquisas recentes sobre implementação da norma ISO 9001 no setor industrial, destacam-se os autores: Fikru, 2014; Ullah, Wei e Xie, 2014; Hudson e Orviska, 2013; Chalak e Abiad, 2012; Kurdve et al., 2014; Sumaedi e Yarmen, 2015 e Thai et al., 2014. A aplicação da norma ABNT NBR ISO 9001 no contexto da saúde, apresenta alguns resultados através do levantamento bibliográfico e ilustrados no Quadro 1.
Quadro 1 – Dimensões de análise da norma ABNT NBR ISO 9001 no setor da saúde
Dimensões de análise |
Autores |
Satisfação do paciente |
Kazmierczaka e Bogusz-Czerniewicza, 2012 ; Broeck et al., 2012 |
Aceitação do conceito de Gestão da Qualidade e da norma |
Castillo e Sardi, 2012; Pereira et al., 2015. |
Implementação de um Sistema de Gestão da Qualidade |
Garcia et al., 2013; Guerra et al., 2014; Bogusz-Czerniewicz e Kazmierczak, 2012. |
A dimensão de análise de satisfação do paciente, refere-se a implantação da norma buscando evidências quanto a satisfação do cliente. Kazmierczaka e Bogusz-Czerniewicza (2012) apresentaram soluções implementadas na instituição de saúde da Polônia no contexto de identificação dos requisitos do paciente e avaliação do nível de satisfação dos pacientes em conformidade com os requisitos da norma ABNT NBR ISO 9001. Broeck et al., (2012) descreveram o processo de desenvolvimento de um questionário para a gestão de infertilidade.
Em relação a aceitação de um Sistema de Gestão da Qualidade no setor da saúde, Castillo e Sardi (2012) apresentaram uma discussão relativa ao conceito de Gestão da Qualidade em Anestesiologia, que apesar de ser um termo novo no setor da saúde, desenvolveu-se rapidamente. Por outro lado, Pereira et al., (2015) discutiram as boas práticas de fabricação e boas práticas de laboratório, bem como as tendências de padrões de sistema de gestão da qualidade. Os autores afirmam que a ABNT NBR ISO 9001 é amplamente aceita em alguns estabelecimentos de sangue da União Europeia. No entanto, isto não é sinônimo de sua aplicação bem-sucedida. Afirmam os autores que a ABNT NBR NM ISO 15189 deve ser o próximo passo na garantia de um laboratório de triagem de qualidade, uma vez que está focada em laboratórios médicos.
Por fim, alguns autores pesquisaram resultados positivos com a implementação de um Sistema de Gestão da Qualidade, como Garcia et al., (2013) que descreveu o processo de implementação de um Sistema de Gestão da Qualidade segundo a norma ABNT NBR ISO 9001 em um Departamento de Medicina Nuclear. Guerra et al., (2014) certificaram o serviço de enfermagem através de um sistema de gestão da qualidade, comprovando assim, a implementação do sistema com sucesso através do levantamento de 30 indicadores para monitorar o processo. Bogusz-Czerniewicz e Kazmierczak (2012) desenvolveram e categorizaram 352 normas de qualidade na radioterapia em instituições da Polônia.
Devido ao número crescente de empresas certificadas no Brasil 22.128 empresas, pode-se supor uma preferência pela implantação de um sistema de gestão baseado na norma ABNT NBR ISO 9001 em empresas brasileiras. O argumento que sustenta esta abordagem é o fato da implantação de um sistema baseado na norma ABNT NBR ISO 9001 já ser de domínio de empresas de consultoria além de ter menor custo econômico.
A norma ISO 17025 estabelece requisitos gerais para a competência de laboratórios de ensaio e calibração. A finalidade desta norma é demonstrar que as organizações têm um sistema de gestão implementado, que são tecnicamente competentes e capazes de produzir resultados tecnicamente válidos (ABNT NBR ISO/IEC 17025).
Em relação a dimensão de medição de desempenho dos laboratórios através da norma, Van Leeuwen et al., (2013) avaliaram o desempenho de laboratórios em 18 países em desenvolvimento, analisando poluentes orgânicos persistentes (POPs) em amostras ambientais e humanos. O Quadro 2 apresenta as dimensões de análise em relação a norma no setor de saúde. No que diz respeito a importância da certificação, Villalbí et al., (2012) introduziram medidas para melhorar a qualidade de uma organização de saúde pública. Através da análise de processos, desenvolvimento de ações de melhoria, formalizando procedimentos, conhecendo o feedback dos clientes, criação de grupos de melhoria e de auditoria externa ou certificação. Já Menon (2012) avaliou os laboratórios de referência Internacionais que realizam benefícios para a Índia. Investindo em inovação de operações de tecnologia ajudando a melhorar a qualidade dos testes de diagnóstico, bem como oferecendo testes globalmente harmonizado para ensaios clínicos.
Quadro 2 – Dimensão de análise da norma ABNT NBR ISO/IEC 17025 no setor da saúde
Dimensão de análise |
Autores |
Importância da certificação |
Villalbí et al., 2012; Menon, 2012. |
Organismos certificadores |
Handoo e Sood, 2012; Bissell, 2012. |
Ferramentas de apoio para gerenciamento |
Houck et al., 2012 |
Quanto a organismos certificadores, Handoo e Sood (2012) retratam a realidade da Índia em relação a acreditação de laboratórios clínicos, normas e organismos de certificação no país. Bissell (2012) apresentou os requisitos federais para laboratórios de toxicologia clínica no cenário americano. Em relação a estudos que utilizaram ferramentas de apoio para o gerenciamento, Houck et al., (2012) introduziram o método de balanced scorecard para o ambiente de gerenciamento de laboratório.
3.3. ABNT NBR NM ISO 15189
Esta norma estabelece requisitos de qualidade e competências para laboratórios clínicos. Segunda a norma ABNT NBR ISO 15189/IEC foi desenvolvida com base nas normas ISO/IEC 17025 e ABNT NBR ISO 9001 e tem como objetivo essencial o alinhamento com a ABNT NBR ISO/IEC 17025. Os laboratórios podem ser acreditados quanto à sua conformidade com regras e padrões internacionais de gestão e quanto a qualidade da organização. Segundo ABNT NBR ISO 15189/IEC Apresenta como aspecto negativo não fornecer indicadores quanto a competência técnica, nem quanto a capacidade de fornecer resultados precisos e confiáveis com vista à eventual aceitação dos clientes e parceiros.
O Quadro 3 apresenta autores que realizaram pesquisas empregando a norma ABNT NBR NM ISO 15189 no contexto da saúde, temos no quadro alguns exemplos e dimensões de análise
Quadro 3 – Dimensões de análise da norma ABNT NBR NM ISO 15189 no setor da saúde
Dimensões de análise |
Autores |
Processo de acreditação |
Longa et al., 2013 |
Segurança do paciente |
Allen, 2013; Campbell e Horvatha, 2014; Piva et al., 2014 |
Identificação de indicadores de qualidade de confiança (IQ) |
Plebini et al., 2014; Lay e Akbıyık, 2014 |
Falta de identificação de indicadores de qualidade de confiança (IQ) |
Plebini et al., 2013 |
Garantia da qualidade na fase pós-análitico |
Grecu e Paulescu, 2013 |
Organismos certificadores |
Handoo e Sood, 2012; Verbrugge e Huisman, 2015 |
Falta de resultados intercambiáveis |
Plebani e Panteghini, 2015 |
Influência dos testes laboratoriais de rotina |
Šupak-Smolčić et al., 2015 |
Evolução dos sistemas de avaliação externa da qualidade (EQAS) |
Ceriotti, 2014 |
Alcançar a harmonização dos requisitos |
Piva et al., 2014; Aarsand e Sandberg, 2014; Plebani e Panteghini, 2015 |
Os autores Longa et al., (2013) descrevem os principais passos a seguir como parte de um processo de acreditação de acordo com a patologia molecular padrão de um laboratório da França. Já Allen (2013) pesquisou sobre a segurança do paciente, demostrada com a implementação de um Sistema de Gestão da Qualidade (SGQ) baseado na norma ABNT NBR NM ISO 15189. Campbell e Horvatha (2014) através de uma revisão da literatura apresentaram a falta de notificação, acompanhamento e resultados críticos de ação, que significam situações de risco de vida. Piva et al., (2014) relataram através de dados auditados ao longo de seis meses uma análise do valor crítico de laboratório.
Quanto ao quesito de identificação de indicadores de qualidade de confiança (IQ), alguns autores pesquisaram sobre este assunto, como por exemplo, Plebini et al., (2014) propondo um quadro com critérios e objetivos necessários para promover a harmonização dos indicadores de qualidade de confiança (IQ) disponível na fase de pré-analítica. Também neste sentido, Lay e Akbıyık (2014) identificaram indicadores de qualidade adequado (QI) para a fase pré-analítica em um laboratório no hospital universitário. Plebini et al., (2013), ressaltou em seu estudo, a falta de identificação de indicadores de qualidade de confiança (IQ) e para tanto, desenvolveram um modelo de Indicadores de Qualidade. Grecu e Paulescu (2013), a fim de garantir a qualidade na fase de pós-análitico, obtiveram uma estimativa dos valores de referência para parâmetros eritrocitários de recém-nascidos no sangue venoso, em seu primeiro dia de vida, para atender os requisitos de acordo com a exigência da norma ABNT NBR NM ISO 15189 de qualidade e competência.
Em relação ao organismos certificadores, Handoo e Sood (2012) retratam a realidade da Índia em relação a acreditação de laboratórios clínicos, normas e organismos de certificação no país. Em contra partida, Verbrugge e Huisman (2015) verificaram e comprovaram que um contador de células de sangue (analisador de hematologia) pode ser feito de acordo com o Instituto de Padrões Clínicos e Laboratoriais ou o Comitê Internacional para Padronização em Hematologia.
Plebani e Panteghini (2015) trataram da falta de resultados intercambiáveis na prática entre os laboratórios clínicos que tem sustentado uma maior atenção aos projetos de normalização e de harmonização. Os autores Šupak-Smolčić et al., (2015) pesquisaram sobre a influência dos testes laboratoriais de rotina, e concluiram que, o jejum prolongado e atividade leve não vai influenciar a decisão médica para indivíduos saudáveis com resultados normais. Ceriotti (2014) analisou a evolução dos sistemas de avaliação externa da qualidade (EQAS), concentrando-se sobre a necessidade de valores-alvo com base em métodos de referência e material de controle comutabilidade.
Ainda, alguns autores como Aarsand e Sandberg (2014) sugeriram níveis de hamornização e etapas do processo de testes, que poderiam ser responsáveis por facilitar e monitorar os efeitos de harmonização, e barreiras possíveis para alcançar uma harmonização. Plebani e Panteghini (2015) trataram também de alguns quesitos no âmbito da harmonização. Piva et al., (2014) através de dados, salientou da falta de harmonização entre os requisitos em laboratórios clínicos.
A adoção das normas ISO através da efetividade dos requisitos, se faz vantajosa e possibilita maior organização, produtividade e credibilidade. Na norma ABNT NBR ISO 9001 os requisitos de gestão em sua maioria se caracterizam como controle de documentos para a implantação de um Sistema de Gerenciamento da Qualidade. Já na norma ABNT NBR ISO/IEC 17025, além de controle dos documentos, fornece itens de análise crítica de pedidos, propostas e contratos entre outros. Na norma ABNT NBR NM ISO 15189, por sua vez, serviços de consultoria e exames laboratorias efetuados por laboratórios referenciados são itens que, por exemplo, não constam nas outras normas.
Quanto aos requisitos técnicos, a norma ABNT NBR ISO 9001 apresenta um número pequeno de itens a serem controlados. Apenas a realização do produto e medição e monitoramento estão contemplados. Segundo Purushothama (2010), atualmente a norma é tida como requisito fundamental para qualquer organização sobreviver. Na norma ABNT NBR ISO/IEC 17025 estes itens são detalhados e amplos incluindo referência à mão-de-obra com competência para operar equipamentos específicos, acomodações e condições ambientais, seleção para o método de amostragem entre outros. A norma ABNT NBR NM ISO 15189 apresenta itens ainda mais controlados como a garantia da qualidade dos procedimentos de exame.
A norma ABNT NBR ISO 9001 estabelece requisitos de gestão e técnicos para a implantação de Sistema de Gerenciamento da Qualidade de uma organização, descrevendo passos para atendimento de tais requisitos. Já a norma ABNT NBR ISO/IEC 17025 estabelece requisitos gerais para a competência de laboratórios de ensaio e calibração e, contempla em grande parte os requisitos da norma ABNT NBR ISO 9001. Por fim, a norma ABNT NBR NM ISO 15189 estabelece requisitos de qualidade e competências para laboratórios clínicos, desenvolvida com base nas normas ABNT NBR ISO/IEC 17025 e ABNT NBR ISO 9001 e tem como objetivo essencial o alinhamento com a ABNT NBR ISO/IEC 17025. Para tanto, a norma ABNT NBR NM ISO 15189 caracteriza-se como a mais completa tanto em requisitos técnicos quanto requisitos de gestão.
Alguns dos requisitos de gestão estão contidos nas três normas. É o caso da análise e controle de documentos da organização. A norma ABNT NBR NM ISO 15189 apresenta a maior quantidade de requisitos. Isto ocorre, possivelmente, por esta norma ser a mais específica de todas. Além disso, as atualizações da norma ABNT NBR ISO 9001 tem feito com que ela torne-se mais geral, permitindo sua implantação em partes da organização com parte dos requisitos. A norma ABNT NBR NM ISO 15189 é a norma que melhor compreende os requisitos técnicos exigidos pela Agência Nacional de Saúde Suplementar através da normativa nº 275/11.
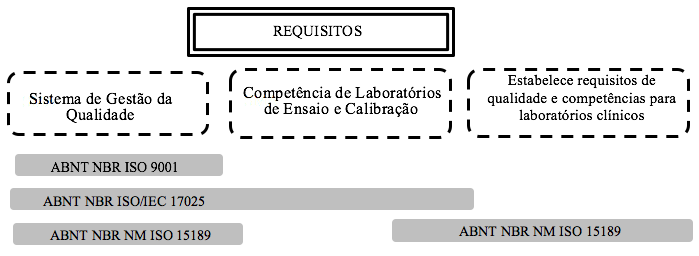
A Figura 2 ilustra as sobreposições entre as três normas. A ABNT NBR ISO 9001 é a norma mais sucinta, apresentando em sua maioria aspectos gerenciais para implantação de um Sistema de Gestão da Qualidade. A ABNT NBR ISO/IEC 17025 prenche lacunas deixadas pela ABNT NBR 9001 e, por fim, a norma ABNT NBR NM ISO 15189 surge para especificar a ação de laboratórios clínicos. Assim, a norma ABNT NBR NM ISO 15189 torna-se a norma padrão para organizações que necessitam de acreditação e buscam maiores fatias no mercado altamente competitivo dos laboratórios clínicos.
Figura 1 - Relacionamento entre as normas ABNT NBR ISO 9001, ABNT NBR ISO/IEC 17025 e ABNT NBR NM ISO 15189
A Tabela 3 apresenta a relação existente entre elas, ilustrando as similaridades e diferenças entre os principais requisitos levantados. A partir da tabela pode-se observar que as normas ABNT NBR ISO 9001 e ABNT NBR ISO/IEC 17025 se sobrepõem com os seguintes itens: Sistema de Gestão da Qualidade, controle de documentos e registros, organização, auditorias internas, atendimento ao cliente, resolução de reclamações, identificação e controle de não-conformidade, ações corretivas e preventivas, melhoria contínua, registros de qualidade, revisão pela direção e medição, análise e melhoria.
O elevado número de requisitos sobrepostos se devem ao fato que a norma ABNT NBR ISO/IEC 17025 utilizar os paramêtros da ABNT NBR ISO 9001 e complementá-los com requisitos técnicos não expostos ou tratados pela outra norma. A conformidade do Sistema de Gestão da Qualidade sob o qual o laboratório opera com os requisitos da ABNT NBR ISO 9001 por si só não demostra a competência do laboratório para produzir dados e resultados tecnicamente válidos e neste sentido, laboratórios de calibração e ensaios devem buscar a acreditação na norma ABNT NBR ISO/IEC 17025.
Considerando a interação entre a norma ABNT NBR ISO 9001 e 15189, os requisitos sobrepostos são em ainda maior número. Isto justifica-se pelo fato da norma ISO 15189 ser mais abrangente e detalhada em especificações para laboratórios clínicos. Entretanto, ao analisar as normas ABNT NBR ISO/IEC 17025 e 15189, evidencia-se a sobreposição de alguns itens, porém requisitos como a revisão de contratos, aquisição de produtos e serviços externos, serviço de consultoria não são contemplados na norma ABNT NBR ISO/IEC 17025.
Tabela 3: Integração entre as normas
|
Requisitos |
IS0 9001:2008 |
ISO 17025:2005 |
ISO 15189:2006 |
GESTÃO |
Sistema de Gestão da Qualidade (SGQ) |
X |
X |
X |
Controle de documentos e de registros |
X |
X |
X |
|
Responsabilidade da direção |
X |
|||
Gestão de recursos |
X |
|||
Organização |
X |
X |
X |
|
Auditorias internas |
X |
X |
X |
|
Aquisição de produtos e serviços |
X |
X |
||
Análise crítica de pedidos, propostas e contratos |
X |
|||
Subcontratação de ensaios e calibrações |
X |
|||
Exames laboratoriais efetuados por laboratórios referenciados e subcontratados |
X |
|||
Aquisição de serviços e suprimentos |
X |
|||
Atendimento ao cliente |
X |
X |
||
Revisão de contratos |
X |
|||
Aquisição de produtos e serviços externos |
X |
|||
Serviços de consultoria |
X |
|||
Resolução de reclamações |
X |
X |
X |
|
Identificação e controle de não-conformidades |
X |
X |
X |
|
Ações corretivas |
X |
X |
X |
|
Ações preventivas |
X |
X |
X |
|
Melhoria contínua |
X |
X |
X |
|
Registros da Qualidade |
X |
X |
X |
|
Registros Técnicos |
X |
X |
||
Revisão pela Gestão |
X |
X |
X |
|
TÉCNICOS |
Realização do Produto |
X |
||
Medição, análise e melhoria |
X |
X |
X |
|
Pessoal |
X |
X |
||
Acomodações e condições ambientais |
X |
X |
||
Métodos de ensaio, de calibração e validação de métodos |
X |
|||
Instalações e condições ambientais |
X |
|||
Equipamentos |
X |
X |
||
Rastreabilidade das medições |
X |
X |
||
Amostragem |
X |
X |
||
Manuseamento dos itens a ensaiar ou a calibrar |
X |
|||
Procedimentos pré-exame ou pré-analíticos |
X |
|||
Procedimentos de exame ou da fase analítica |
X |
|||
Garantia da qualidade dos procedimentos de exame ou da fase analítica |
X |
|||
Procedimentos pós-exame ou pós-analíticos |
X |
|||
Apresentação dos resultados |
|
X |
X |
O presente artigo buscou analisar as similaridades e diferenças entre as normas ABNT NBR ISO 9001, ABNT NBR ISO/IEC 17025 e ABNT NBR NM ISO 15189. No que tange a aplicabilidade das normas, estas podem ser utilizadas como base para o desenvolvimento de um sistema integrado de gestão que culmine na acreditação em laboratórios. As normas apresentam similaridades ou sobreposição de requisitos, tais como sistema de gerenciamento da qualidade, controle de documentos, atendimento a reclamações de clientes, ações corretivas e preventivas e diferenças no que diz respeito principalmente aos requisitos técnicos.
Um dos aspectos relevantes levantado na literatura, diz respeito a criação e acompanhamento de indicadores (Fikru (2014); Ullah, Wei e Xie (2014); Kurdve et al., (2014); Garcia et al., (2013); Guerra et al., (2014); Bogusz-Czerniewicz e Kazmierczak (2012); Houck et al., (2012); Plebini et al., (2014); Lay e Akbıyık (2014); Plebini et al., (2013). Este aspecto é comum as três normas e além disso é pilar fundamental do Sistema Qualiss. Complementar isto, foi encontrado na literatura (Allen, 2013; Campbell e Horvatha, 2014; Piva et al., 2014) que tão somente a norma ABNT NBR NM ISO 15189 leva em consideração aspectos que envolve a segurança do paciente, outro pilar fundamental com o Sistema Qualiss.
Quanto a efetividade e eficiência domínios primordias no Sistema Quallis, foram achados na literura com (Grecu e Paulescu, 2013; Villalbí et al., 2012; Menon, 2012; Garcia et al., 2013; Guerra et al., 2014; Bogusz-Czerniewicz e Kazmierczak, 2012) e identificada nas três normas em análise. Por fim, os domínios de centralidade do paciente e equidade não foram encontrados na literatura. A literatura mostra que o conhecimento obtido na implantação de um sistema integrado para a gestão da qualidade pode ser transferido de forma simplificada para a implantação na área de laboratório clínicos. O mesmo pode ser aplicado em relação a outras normas, menos usuais, mesmo que mais indicadas. Os resultados demonstram que a norma ABNT NBR NM ISO 15189 é a que melhor atende as demandas solicitadas pela Agência Nacional de Saúde Suplementar, frente a compreensão geral dos requisitos e sua visão sistêmica do negócio que engloba laboratórios clínicos.
Os autores agradecem a CAPES pelo suporte financeiro para execução da pesquisa.
AARSAND, A. K.; SANDBERG, S. (2014); "How to achieve harmonisation of laboratory testing - The complete picture". Clinica Chimica Acta, v. 432, p. 8–14.
ACEVEDO, C. R; NOHARA, J. J. (2013); Como fazer monografias. 4 ed. Atlas, São Paulo.
AGÊNCIA NACIONAL DE SAÚDE SUPLEMENTAR (ANS). QUALISS - Programa de Qualificação de Prestadores de Serviços de Saúde. Disponível em: < http://www.ans.gov.br/ espaco-dos-prestadores/qualiss>. Acesso em: 14 março 2014.
ALLEN, L. C. (2013); "Role of a quality management system in improving patient safety - Laboratory aspects". Clinical Biochemistry, v. 46, p. 1187–1193.
ANAHP, Livro Branco: Brasil Saúde 2015. (2014); A sustentabilidade do sistema de saúde brasileiro.
ANDRADE, M. M. (2010); Introdução à metodologia do trabalho científico: elaboração de trabalhos na graduação. 10ª ed. São Paulo: Atlas.
ANVISA. (2004); "Acreditação: a busca pela qualidade nos serviços de saúde". Revista de Saúde Pública, v. 38, n. 2, p. 335-6.
ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS (ABNT). Histórico da normatização. Disponível em: http://www.abntcb25.com.br/informanorma.pdf. Acesso em: 01 novembro de 2014
ASSOCIACAO BRASILEIRA DE NORMAS TECNICAS. (2000); Sistemas de gestão da qualidade – Fundamentos e vocabulário. NBR ISO 9001a. Rio de Janeiro, 21p.
ASSOCIACAO BRASILEIRA DE NORMAS TECNICAS. Sistemas de gestão da qualidade – Requisitos. NBR ISO 9001 b. Rio de Janeiro, 2000. 48 p.
BECKER, A. (2004); A Gestão de laboratórios de análises clínicas por meio de indicadores de desempenho através da utilização do Balanced Scorecard.136f. Dissertação (Mestrado Profissionalizante em Engenharia). Escola de Engenharia. Universidade Federal do Rio Grande do Sul. Porto Alegre. 2004.
BITTAR, O. J. N. V. (2004); "Indicadores de qualidade e quantidade em saúde". Revista da Administração Saúde, v. 6, n. 22.
BISSELL, M. G. (2012); "Regulatory Issues in Accreditation of Toxicology Laboratories". Clinics in Laboratory Medicine, v. 32, p. 525–542.
BOGUSZ-CZERNIEWICZ, M.; KAZMIERCZAK, D. (2012);"Organizational, technical, physical and clinical quality standards for radiotherapy". Reports of practical oncology and radiotherapy. v. 1, n, 7, p. 190–199.
BONFA, S. (2010); "Modelo de Excelência da Gestão da FNQ e normas NBR ISO 9004/ NBR ISO 9001: Modelos complementares ou Concorrentes". VI Congresso Nacional De Excelência em Gestão Energia, Inovação, Tecnologia e Complexidade para a Gestão Sustentável. Rio de Janeiro.
BROECK, U. V. et al., (2012); "Patient evaluation of infertility management in an ISO 9001:2008-certified centre for reproductive medicine". Reproductive BioMedicine Online, v. 24, p. 293– 300.
BRONES, F.; CARVALHO, M. M.; ZANCUL, E. S. (2014); "Ecodesign in project management: a missing link for the integration of sustainability in product development". Journal of Cleaner Production, v.80, p.106-118.
BUCCELLI, D. O.; NETO, P. (2013); Prêmio Nacional da Qualidade: Gestão da Qualidade ou Qualidade da Gestão. XXXIII Encontro Nacional De Engenharia De Produção.
CAMPBELL, C.A.; HORVATH, A. R. (2014); "Harmonization of critical result management in laboratory medicine". Clinica Chimica Acta, v. 432, p. 135–147.
CASTILLO, A; SARDI, N.(2012); "ISO standards and the quality concept applied to anesthesia services". Revista Colombia Anestesiol. v. 40, n, 1, p. 14-16.
CERIOTTI, F. (2014); "The role of External Quality Assessment Schemes in Monitoring and Improving the Standardization Process". Clinica Chimica Acta, v. 432, p. 77–81.
CHALAK, A; ABIAD, M. (2012). "How effective is information provision in shaping food safety related purchasing decisions? Evidence from a choice experiment in Lebanon". Food Quality and Preference. v. 26, p. 81–92.
DOCKING, D. S.; BOWEN, R. J. (1999); "Market interpretation of ISO 9000 registration". Journal Financial Research, v, 22, n, 2, p. 147–160.
DOMINGUES, J. P. T. Sistemas de gestão integrados: desenvolvimento de um modelo para avaliação do nível de maturidade. Tese de Doutorado Programa em Engenharia Industrial e de Sistemas. Universidade do Minho. 2013.
DU, H. et al. (2013); "A bibliometric analysis of recent energy efficiency literatures: an expanding and shifting focus". Energy Efficiency, v.6, n.1, p.177-190.
FELDMAN, L. B. et al. (2005); "História da evolução da qualidade hospitalar: dos padrões à acreditação". Acta Paul Enferm, v. 18, n. 2, p. 213-9.
FIKRU, M. G. (2014); "Firm Level Determinants of International Certification: Evidence from Ethiopia". World Development, v. 64, p. 286–297.
FUNDAÇÃO NACIONAL DA QUALIDADE - FNQ. (2008); Cadernos Compromisso com a Excelência: Introdução ao Modelo de Excelência da Gestão (MEG). São Paulo: Fundação Nacional da Qualidade.
GARCÍA, V. M. P et al., (2013); "Implementation of a Quality Management System according to the UNE-UN-ISO 9001:2008 standard in a Nuclear Medicine Department". Revista Española Medicina Nuclear Imagen Molecular, v. 32, n, 1, p. 1–7.
GUERRA, R. S. et al., (2014); "Certificación de los servicios enfermeros. Norma UNE-EN-ISO 9001-2008". Revista de Calid Asistencial, v. 29, n. 6, p. 350 – 354.
GUZEL, O; GUNER, E. I. (2009); "ISO 15189 Accreditation: Requirements for quality and competence of medical laboratories, experience of a laboratory". Clinical Biochemistry. v. 42, p. 274–278.
GRECU, D. S.; PAULESCU, E. (2013); "Quality in post-analytical phase: Indirect reference intervals for erythrocyte parameters of neonates". Clinical Biochemistry, v. 46, p. 617–621.
HANDOO, A.; SOOD, S. K. (2012); "Clinical Laboratory Accreditation in India".Clinical Laboratories Medicine, v. 32, p. 281–292.
HELPER, S. et al., (2002); "Employee involvement and pay at American auto suppliers". Journal Economia Management Strategy, v.11, n. 2, p. 329 – 377.
HENDRICKS, K. B.; SINGHAL, V. R. (1996); "Quality awards and the market value of the firm: An empirical investigation". Management Science, v.42, n. 3, p. 415–436.
HENDRICKS, K. B.; SINGHAL, V. R. (1997); "Does implementing an effective TQM program actually improve operating performance? Empirical evidence from firms that have won quality awards". Management Science, v. 43, n. 9, p. 1258 – 1274.
HENDRICKS, K. B.; SINGHAL, V. R.. (2001a); "Firm characteristics, total quality management, and financial performance: An empirical investigation". Journal Operations Management, v.19, n. 3, p. 269–285.
HENDRICKS, K. B.; SINGHAL, V. R. (2001b); "The long-run stock price performance of firms with effective TQM programs as proxied by quality award winners". Management Science, v. 47, n. 3, p. 359 – 368.
HOUCK, M. et al., (2012); "The balanced scorecard: Sustainable performance assessment for forensic laboratories". Science and Justice, v. 52, p. 209–216.
HUDSON, J.; ORVISKA, M. (2013); "Firms'adoption of international standards: One size fits all?" Journal of Policy Modeling, v. 35, p. 289–306.
INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA (IBGE). Site institucional: Disponível em: http://www.sbpc.org.br/index.php?C=1573. Acesso 12 de novembro de 2014.
______. NBR ISO 9001: Sistema de Gestão da Qualidade – Requisitos. ABNT, Rio de Janeiro, 2008.
______. NBR ISO 17025: Requisitos gerais para a competência de laboratórios de ensaio e calibração. ABNT, Rio de Janeiro, 2005.
______. NBR ISO 15189: Requisitos de qualidade e competência em laboratórios de análises clínicas. 2006.
KARAPETROVIC, S. (2003); "Musings on integrated management systems". Measuring Business Excellence, v. 7, n. 1, p. 4-13.
KAZMIERCZAK, D. BOGUSZ-CZERNIEWICZ, M. (2012); "Identification of patient's requirements in quality management system in health care institutions". Reports of practical oncology and radiotherapy, v. 17, p. 50–53.
KOBS, A. (2006); "ISO 9001:2000 a Support for Professional Nursing Practice". Nurse Leader, v. 4, p. 27-49.
KURDVE, M. et al., (2014); "Lean and green integration into production system models e experiences from Swedish industry. Journal of Cleaner Production, v. 85, p. 180 – 190.
LAY, I. S.; AKBIYIK, A. P. (2014); "Classification of reasons for rejection of biological specimens based on pre-preanalytical processes to identify quality indicators at a university hospital clinical laboratory in Turkey". Clinical Biochemistry, v. 47, p. 1002–1005.
LEVINE, D.; TOFFEL, M. W. (2010); "Quality Management and Job Quality: How the ISO 9001 Standard for Quality Management Systems Affects Employees and Employers." Management Science, v. 56, n. 6, p. 978–996.
LIMA, E. C.; ANGELO, M. L. B.; DEMARCHI, T. M. (2013); "Auditoria de qualidade: melhoria dos processos em um hospital público". Revista de Administração em Saúde. v. 15, n, 58.
LONGA, E. et al., (2013); "Accréditation de l'activité de pathologie moléculaire selon la norme ISO 15189. Principales étapes à respecter et principaux écueils possibles". Annales de pathologie, v. 33, p. 12—23.
MENON, P. K. (2012); "International ReferenceLaboratories". Clinical Laboratories Medicine, v. 32, p. 327–340.
MIGUEL, A. S., et al., (2012); Sistemas em foco: Guia para Sistemas de Gestão da Segurança e Saúde do Trabalho. Ordem dos Engenheiros-RN edts.
MOONSAMY, V; SINGH, S. (2014); "Using factor analysis to explore principal components for quality management implementation". Quality & Quantity, v. 48, n. 2, p. 605–622.
NASCIMENTO, A. P. et al., (2013); "Maturidade de Sistemas de Gestão da Qualidade como um Construto de Segunda Ordem". Gestão & Tecnologia, v. 13, n. 3, p. 23-50.
NASCIMENTO, A. P. (2012); Avaliação do nivel de maturidade de Sistemas de Gestão da Qualidade dos fornecedores e possíveis impactos dos seus resultados de desempenho. Dissertação (Mestrado) – Programa de Pós Graduação em Administração. Universidade Federal do Espírito Santo. Vitória.
PEREIRA, P. et al., (2015); "Quality management in European screening laboratories in blood establishments: A view of current approaches and trends". Transfusion and Apheresis Science.
PIVA, E. et al., (2014); "Laboratory critical values: Automated notification supports effective clinical decision making". Clinical Biochemistry, v. 47, p. 1163–1168.
PLEBANI, M. (2003); "Appropriateness in programs for continuous quality improvement in clinical laboratories". Clinical Chim Acta, v. 333, p. 131-9.
PLEBANI, M. (2009); "Exploring the iceberg of errors in laboratory medicine". Clin Chim Acta, v. 404, p. 16-23.
PLEBANI, M. et al., (2013); "Quality indicators in laboratory medicine: A fundamental tool for quality and patient safety". Clinical Biochemistry, v. 46, p. 1170–1174.
PLEBANI, M. et al., (2014); "Quality indicators to detect pre-analytical errors in laboratory testing". Clinica Chimica Acta, v. 43, p. 44–48.
PLEBANI, M.; PANTEGHINI, M. (2015); "Promoting clinical and laboratory interaction by harmonization". Clinica Chimica Acta, v. 432, p. 15–21.
PLEBANI, M. ZANINOTTO, D. F. (2014); "Utilization management: A European perspective". Clinica Chimica Acta, v. 427, p. 137–141.
ROSENBERG, G. (2000); A ISO na indústria farmacêutica: Uma abordagem das boas práticas de fabricação. Rio de Janeiro: E-papers.
ŠUPAK-SMOLČIĆ, V. et al., (2015); "Influence of a prolonged fasting and mild activity on routine laboratory tests". Clinical Biochemistry, v. 48, p. 85–88.
SAMPAIO, P., SARAIVA, P.; DOMINGUES, P. (2012); "Management systems: Integration or addition?". International Journal of Quality and Reliability Management, v. 29, n. 4, p. 402-424.
SAMPAIO, P.; SARAIVA, P. (2011); Qualidade e as normas ISO 9000: Mitos, verdades e consequências. Verlag edts.
SILVA, E.; MENEZES, E. (2005); Metodologia da pesquisa e elaboração da dissertação. 4 ed. Florianópolis: UFSC.
SIMON, A., KARAPETROVIC, S. E CASADESUS, M. (2012a); 'Evolution of integrated management systems in Spanish firms". Journal of Cleaner Production, n, 23, p. 8-19.
SIMON, A., BERNARDO, M., KARAPETROVIC, S. E CASADESUS, M. (2012b); "Implementing integrated management systems in chemical firms". Total Quality Management and Business Excellence.
SUMAEDI, S.; YARMEN, M. (2015); "The Effectiveness of ISO 9001 Implementation in Food Manufacturing Companies: A Proposed Measurement Instrument". Procedia Food Science, v. 3, p. 436 – 444.
VAN LEEUWEN, B. et al.,. (2013); "POPs analysis reveals issues in bringing laboratories in developing countries to a higher quality level". Trends in Analytical Chemistry, v. 46.
VALLS, V. M. (2005); Gestão da Qualidade em serviços de informação no Brasil: estabelecimento de um modelo de referência baseado nas diretrizes da NBR ISO 9001. Tese de doutorado. Programa de Pós Graduação em ciência da comunicação. USP.
VERBRUGGE, S. E.; HUISMAN, A. (2015); "Verification and Standardization of Blood Cell Counters for Routine: Clinical Laboratory Tests". Clinical Laboratoris Medicine, v. 35, p. 183–196.
THAI, V. V. et al., (2014); "Defining Service Quality in Tramp Shipping: Conceptual Model and Empirical Evidence". The Asian Journal of Shipping and Logistics, v. 30, n. 1, p. 001-029.
VILLALBÍ, J. R. et al., (2012); "Gestión de calidad en una organización de salud pública". Gaceta Sanitaria, v. 26, n. 4, p. 379–382.
ULLAH, B.; WEI, Z.; XIE, F. (2014); "ISO certification, financial constraints, and firm performance in Latin American and Caribbean countries". Global Finance Journal, v. 25, p. 203–228.
VIEIRA, L. M. F. et al., (2010); "Nova era para a acreditação de laboratórios". Journal Brasileiro Patologia Medicine Laboratorial, v. 41, n. 4.1. PPGEPS/UNISINOS. email: marianecasseres@gmail.com
2. PPGEPS/UNISINOS
3. Engenharia de Produção/PUCRS - PPGEP/UFRGS