

Vol. 38 (Nº 41) Año 2017. Pág. 17
Elãine Christine dos Santos DOURADO 1; Antonio Carlos Leal de CASTRO 2; Oscarina Viana de SOUSA 3; Raúl Cruz IZQUIERDO 4
Recibido: 06/04/2017 • Aprobado: 05/05/2017
RESUMO: Este estudo objetivou caracterizar o ictioplâncton do Baixo Rio Itapecuru (MA), analisando sua ocorrência e distribuição espacial. Nas amostragens trimestrais (de maio de 2012 a outubro de 2014), foram capturadas 3.178 larvas e 1.776 ovos. Os resultados revelaram a ocorrência de ovos em todos os locais de amostragem, principalmente no período chuvoso (janeiro a maio), e predomínio de larvas de Characiformes (37,16%), Siluriformes (34,27%) e Perciformes (15,39%). As maiores densidades médias foram registradas na região à montante da área de estudo e diferenças significativas foram observadas apenas na distribuição espacial das larvas. |
ABSTRACT: This study aimed to characterize Ichthyoplankton of the Lower Itapecuru River (MA) analyzing its occurrence and spatial distribution. In the quarterly samplings (from May 2012 to October 2014), 3,178 larvae and 1,776 eggs were captured. The results showed eggs at all sampling sites, mainly in the rainy season (January to May), and predominance of larvae of Characiformes (37.16%), Siluriformes (34,27%) and Perciformes (15,39) %). The highest mean densities were recorded in the region upstream of the study area and significant differences were observed only in the spatial distribution of the larvae. |
O ictioplâncton, composto pelos ovos e larvas de peixes, representa um importante elo nos ecossistemas aquáticos, uma vez que desses organismos depende o estoque de peixes adultos (REYNALTE-TATAJE et al., 2013; HARE; RICHARDSON, 2014). Estudos relacionados às fases iniciais de desenvolvimento desses organismos são fundamentais para o entendimento da biologia das espécies, por representarem um período crítico do seu ciclo de vida (NAKATANI et al., 2001).
Estudos sobre o ictioplâncton, além de serem relevantes para o conhecimento da biologia e sistemática das espécies de peixes, são indispensáveis à detecção de novos estoques, à avaliação daqueles já explorados (STRATOUDAKIS et al., 2006; HOUDE, 2008), bem como à identificação e delimitação de áreas de desova (NASCIMENTO; NAKATANI, 2006; KIPPER et al., 2011; GOGOLA et al. 2013).
Em ambientes neotropicais, observa-se um aumentado significativo desses estudos nos últimos anos (REYNALTE-TATAJE et al., 2012a). No Brasil, esse incremento é recente e concentrado a ambientes localizados nas regiões sudeste (ZIOBER et al., 2007, 2012; DAGA et al., 2009; REYNALTE-TATAJE et al., 2007, 2012a,b; GOGOLA et al., 2010; KIPPER et al., 2013; BARZOTTO et al., 2015), norte (ARAÚJO-LIMA; OLIVEIRA, 1998; LIMA; ARAÚJO-LIMA, 2004; LEITE et. al., 2006; OLIVEIRA; FERREIRA, 2008; ZACARDI, 2015) e centro-oeste (BIALETSKI et al., 2004, 2005; TONDATO et al., 2010; TAGUTI et al., 2015). No Maranhão, tais informações são inexistentes para ambientes continentais. Para esta região, os registros são apenas para ambientes marinhos e estuarinos (JURAS, 1983, 1984 e 1985; SILVEIRA, 2003; ANDRADE, 2006; SOARES et al., 2014).
O Maranhão é um dos Estados brasileiros que se destaca por sua malha hidrográfica de grandes dimensões, cujos rios distinguem-se por serem permanentes e manterem expressivo volume de água durante todo o ano (ALCÂNTARA, 2004). Das bacias perenes, destacam-se as de maior extensão: Mearim (99.920 Km2), Itapecuru (52.972 Km2) e Gurupi (34.775 Km2) (MMA, 2006).
A bacia do Itapecuru tem grande importância para o desenvolvimento do Maranhão. Ocupa 16% do seu território e abrange 52 municípios, sendo responsável pelo abastecimento de 75% da população da capital São Luís. O Rio Itapecuru, que define a bacia, teve importante papel no povoamento de diversas cidades do interior devido a sua fácil navegabilidade, servindo de via de acesso para o desenvolvimento do comércio no Estado (SILVA; CONCEIÇÃO, 2011). Atualmente, em seu baixo curso, localiza-se a concentração industrial mais significativa do Estado, em função da existência do Distrito Industrial de São Luís e dos projetos minero-metalúrgicos da Vale e da ALUMAR (Alumínios do Maranhão) (MMA, 2006). Em contrapartida, tem sofrido acentuadas modificações em suas características em função do manejo inadequado, queimadas, desmatamentos indiscriminados e outras ações antrópicas que provocam a impermeabilidade do solo, erosão de suas margens e assoreamento de seu leito, ocasionando empobrecimento progressivo da biodiversidade de sua bacia hidrográfica ainda pouco conhecida (SILVA; CONCEIÇÃO, 2011). Para a região, poucos são os estudos considerando a fauna e a flora (ARANHA, 1997; ARAÚJO et al., 1998; PIORSKI et al., 1998; MMA, 2006; BARROS et al., 2011).
Nesse contexto, o objetivo do presente estudo foi caracterizar a composição do ictioplâncton e analisar sua distribuição espacial, através da abundância, em uma área do Baixo Itapecuru (Maranhão, Brasil), fornecendo informações que ampliam o conhecimento sobre as fases iniciais das espécies de peixes da região.
A bacia do rio Itapecuru situa-se na parte centro-leste do Estado do Maranhão, entre as coordenadas 2º51’ a 6º56’ S e 43º02’ a 43º58’ W (Figura 1). O rio Itapecuru, que dá nome à bacia, nasce no município de Mirador e tem cerca de 1.050 km de extensão que se distribuem em terrenos baixos e de suaves ondulações. É caracterizado fisicamente em três regiões distintas: Alto, Médio e Baixo Itapecuru, com base nas características da rede de drenagem, compartimentação e as formas de relevo da bacia (ALCÂNTARA, 2004).
O Alto Itapecuru corresponde ao trecho entre a nascente, na serra de Croeiras (Mirador), até a cidade de Colinas, com uma extensão de aproximadamente 320 km. Possui poucos metros de largura (variando de 5 m a 25 m) e profundidade média de 1,5m. Neste trecho, a presença de declives mais fortes, caracteriza-o como rio de planalto. O Médio Itapecuru inicia-se no município de Colinas e vai até Caxias, em um percurso de cerca de 230 km. Nesta área predomina o relevo de chapadas baixas. O Baixo Itapecuru se estende de Caxias até a foz na Baía do Arraial, com aproximadamente 360 km. As menores declividades encontradas nesse trecho influenciam a velocidade da água, que corre mais tranquilamente, caracterizando-o como um rio de planície. Em seu baixo curso, o rio passa a ser mais piscoso e, nas proximidades da cidade de Rosário, observa-se a mistura de água doce/água salgada (cunha salina), influenciando a fauna e flora (ALCÂNTARA, 2004; MMA, 2006).
Na bacia do Itapecuru, a dominância é do regime fluvial tropical, explicado pela existência de uma estação de águas abundantes, de janeiro a maio/junho, e outra de águas escassas, de julho a novembro/dezembro (MMA, 2006).
A área de estudo (Figura 1) encontra-se situada no Baixo curso do rio Itapecuru (02° 55' 60"S e 44° 14' 60" W), entre os municípios de Santa Luzia e Rosário. As amostragens foram realizadas em três pontos denominados ITA-P01 (Santa Luzia), ITA-P02 (São Miguel), e ITA-P03 (Rosário), situados entre o sistema de captação de água ITALUÍS e a foz no município de Rosário. Esses pontos foram determinados durante um Programa de Monitoramento da Biota Aquática de um empreendimento industrial que seria implantado na região, de forma a cobrir espacialmente a área sujeita a possíveis efeitos de sua construção e operação.
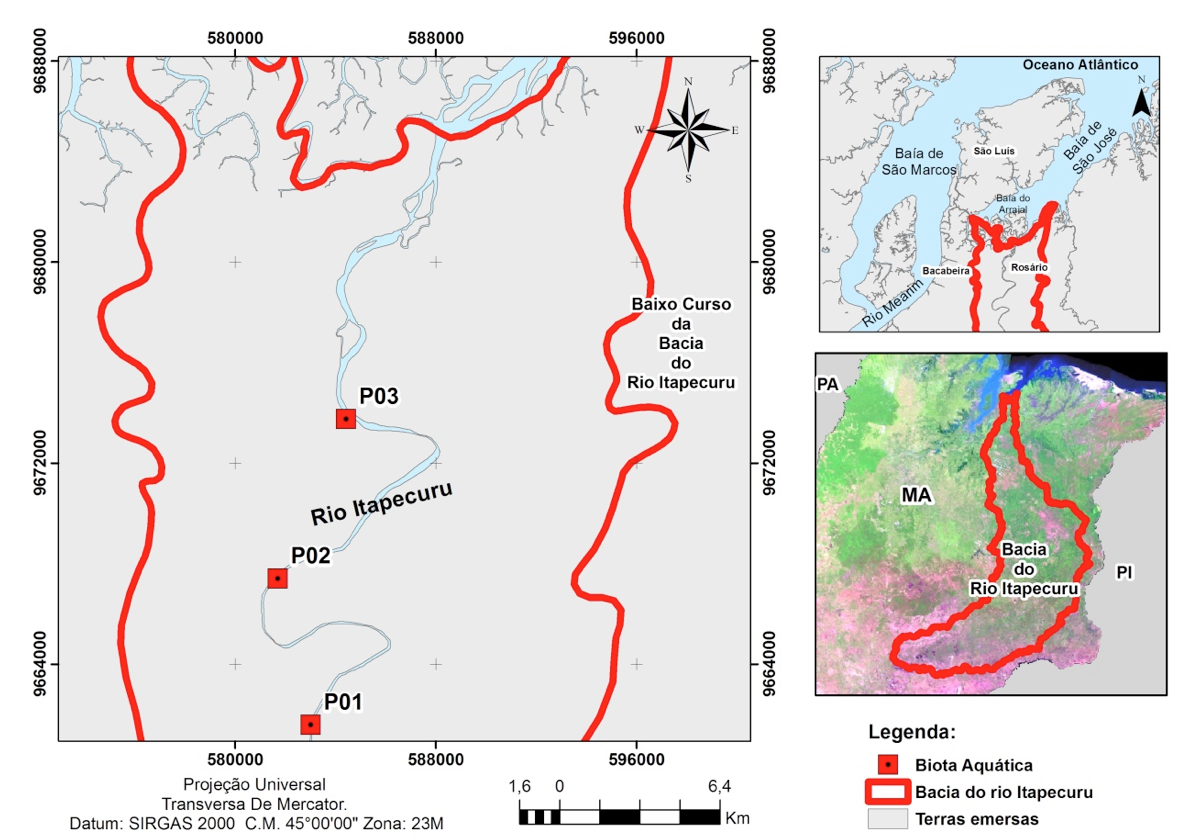
Figura 1. Localização dos pontos de amostragem, no Baixo Itapecuru (Maranhão).
As amostragens ocorreram trimestralmente, entre maio de 2012 e outubro de 2014. O material biológico foi capturado através de arrastos horizontais na superfície da coluna d’água, com duração de aproximadamente 10 minutos, com o auxílio de rede cônico-cilíndrica (malhagem 300 µm), equipada com fluxômetro para determinação do volume de água filtrado. O material coletado foi fixado em formol 4% tamponado com carbonato de cálcio (CaCO3) (NAKATANI et al., 2001).
Em laboratório, as amostras foram triadas sob microscópio estereoscópio em placa do tipo Bogorov, para separação dos ovos e larvas de peixes do restante do plâncton. Em seguida, o material foi quantificado e as larvas, identificadas até o menor nível taxonômico possível, seguindo a técnica de sequência de desenvolvimento proposta por Nakatani et al.(2001). As larvas que não apresentaram características que permitissem sua identificação ou que se encontravam em estágio muito inicial de desenvolvimento foram enquadradas em nível de Ordem ou Família ou na categoria não-identificada (danificada). O enquadramento taxonômico foi baseado em Reis et al. (2003).
Para identificar as espécies mais abundantes na região amostrada, foi utilizada a média aritmética da densidade durante todo o período e a frequência de ocorrência. As densidades dos organismos capturados foram padronizadas para um volume de 10m3 de água filtrada, segundo Tanaka (1973), modificado por Nakatani et al. (2001), utilizando-se a seguinte equação: Y = (X/V)*10, onde: Y = número de indivíduos por 10 m3; X = número de indivíduos coletados e V = volume de água filtrada.
Diferenças espaciais nas abundâncias médias (densidades) de ovos e larvas foram avaliadas através da Análise de Variância unifatorial (ANOVA one way), após terem sido confirmados os pressupostos de normalidade e homocedasticidade (ZAR, 1999). Para reduzir a variabilidade dos dados, os valores de densidade foram previamente log-transformados [log10 (x+1), onde x = densidade]. Em seguida, aplicou-se o teste a posteriori de Tukey para avaliar as diferenças na abundância entre os locais, a um nível de significância de 95% (p < 0,05).
Durante o período de estudo, foram capturadas 3.178 larvas e 1.776 ovos. As larvas identificadas foram distribuídas em seis ordens, representadas principalmente por espécies de pequeno e médio porte. A ordem Characiformes representou 37,16% do total de larvas capturadas e esteve representada por 11 espécies, distribuídas em seis famílias: Acestrorhynchidae (Acestrorhynchus falcatus), Anostomidae (Leporinus cf. friderici e Schizodon dissimilis), Characidae (Astyanax cf. bimaculatus, Moenkhausia sp., Poptella compressa, Roeboides sp., Serrasalmus rhombeus e Triportheus signatus), Curimatidae, Erythrinidae (Hoplias malabaricus), Prochilodontidae (Prochilodus lacustris) (Tabela 1).
Os Siluriformes corresponderam a 34,27% das capturas, sendo amostradas larvas de Auchenipteridae (Ageneiosus aff. ucayalensis e Pseudauchenipterus nodosus), Heptapteridae (Pimelodella parnahybae e Rhamdia sp.), Loricariidae (Loricariichthys nudirostris), Pimelodidae (Pimelodus blochii e Sorubim lima) e Doradidae. Os Perciformes (15,39% das larvas capturadas) foram representados pela família Sciaenidae, com uma espécie, Plagioscion squamosissimus. Larvas de Gymnotiformes (0,57%) estiveram presentes no ictioplâncton, representadas por duas espécies: Gymnotidae (Gymnotus carapo) e Sternoppygidae (Eigenmannia virescens). Larvas de Clupeiformes (1,04%) e Pleuronectiformes (0,09%) foram identificadas apenas a nível de ordem e família (Achiridae), respectivamente. Larvas recém-eclodidas e danificadas totalizaram 11,49% das capturas (Tabela 1).
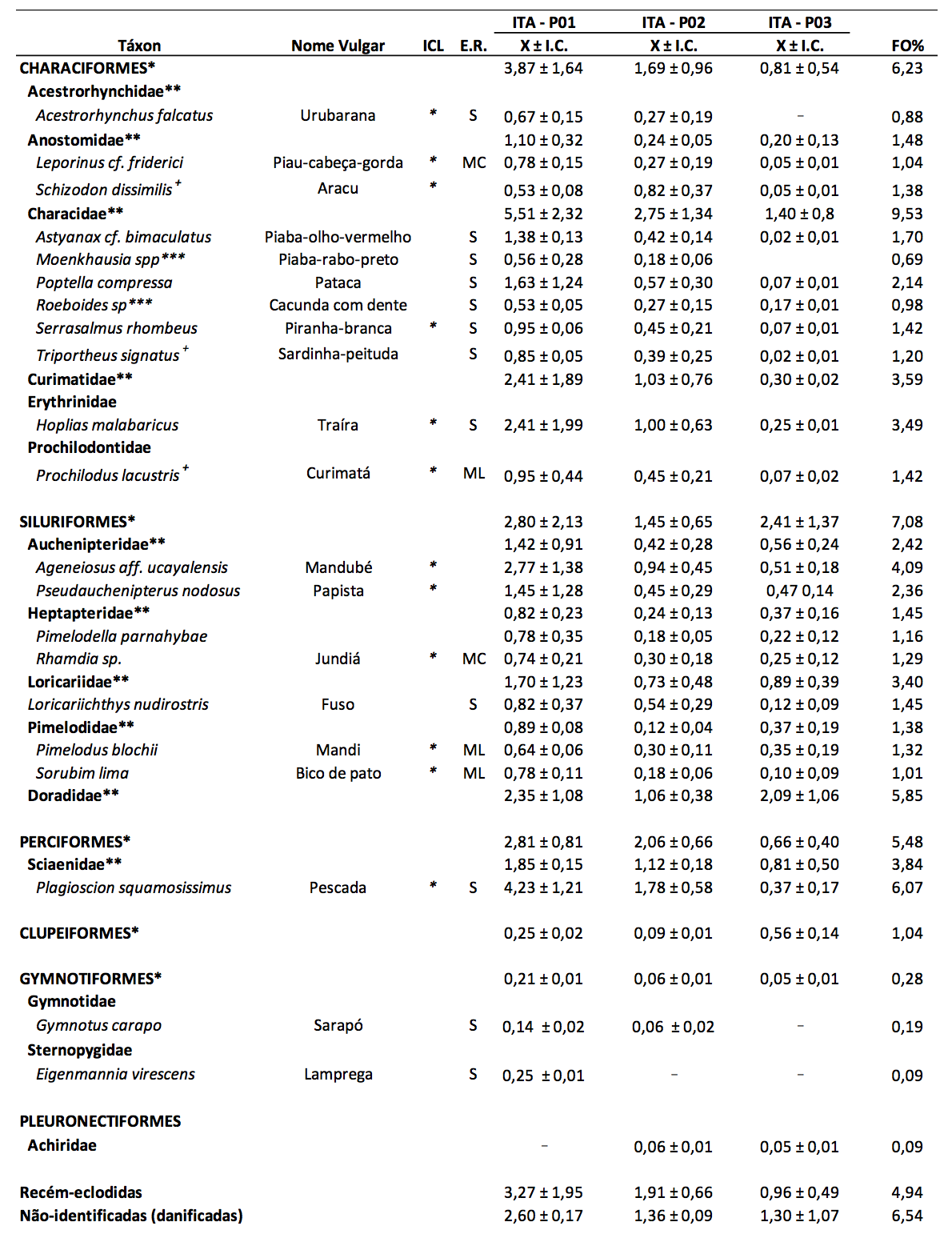
Tabela 1. Composição taxonômica, nome vulgar, importância comercial local (ICL), estratégia reprodutiva (ER),
densidade média (larvas/10 m3) ± intervalo de confiança (X ± I.C.) e frequência de ocorrência (FO%)
das larvas de peixes coletadas, trimestralmente, no período de maio de 2012 a outubro de 2014,
no Baixo Itapecuru (MA, Brasil). (S – sedentária; MC – curta migração; ML – longa migração).
*Larvas identificadas somente a nível de ordem; **Larvas identificadas somente a nível de família; ***Larvas identificadas apenas a nível de gênero. +Larvas endêmicas para o nordeste do Brasil (BARROS et al., 2011).
Peixes das ordens Characiformes e Siluriformes são abundantes em águas da América do Sul e vários autores tem observado a dominância de espécies desses grupos na composição do ictioplâncton em diversos ambientes de água doce (NASCIMENTO; NAKATANI, 2006; KIPPER et al., 2011; REYNALTE-TATAJE et al., 2011, 2012a, b; GOGOLA et al., 2013; ÁVILA-SIMAS et al., 2014) devido, principalmente, a alta fecundidade e ao tamanho grande da população adulta (AZEVEDO, 2010). Para a ordem Characiformes, Bennemann et al. (2000) consideram ainda outros aspectos que atuam nesse sucesso, como a expressiva quantidade de espécies forrageiras, de pequeno porte e sedentária, observado na maioria dos membros da família Characidae, e a grande plasticidade alimentar e capacidade de reprodução em diversos habitats, com muitas espécies concluindo seu ciclo de vida em ambientes lênticos ou de baixa velocidade de corrente.
Além disso, larvas de peixes necessitam de habitats com baixa correnteza para desenvolver suas atividades, como o crescimento e a alimentação (Reynalte-Tataje et al., 2008). Esses ambientes podem ser temporários ou permanentes, mas devem apresentar condições biológicas, físicas e químicas adequadas para o seu desenvolvimento. Geralmente, os locais de crescimento tem pouca ou nenhuma correnteza, como bancos de areia, foz de tributários, canais, áreas de várzea e margens de rios (AGOSTINHO et al., 2004; KING, 2004). A região do Baixo Itapecuru é considerada o trecho de maior navegabilidade do rio, no entanto, devido à baixa declividade do terreno, ocorre formação de bancos de areia (ALCÂNTARA, 2004) o que diminui consideravelmente a velocidade de corrente da água, fazendo com que esse trecho seja caracterizado como um rio de planície (SILVA; CONCEIÇÃO, 2011), propiciando condições favoráveis para o desenvolvimento das larvas de peixes, principalmente de Characiformes.
Os Perciformes foram a terceira ordem de maior abundância no ictioplâncton analisado, com 15,39% das capturas, influenciada pela grande abundância de larvas da família Sciaenidae, cuja espécie ocorrente é Plagioscion squamosissimus. Segundo Menezes et al. (2007), Perciformes é a ordem de maior diversidade dentre os peixes teleósteos, com cerca de 150 famílias e mais de 9.000 espécies. É um táxon cosmopolita, com ocorrência em todos os continentes, a maioria em ambientes marinhos, mas também ocorre em ambientes estuarinos e de água doce (OYAKAWA et al., 2006).
Plagioscion squamosissimus é a representante de água doce da família Sciaenidae registrada na área estudada (PIORSKI et al., 1998; BARROS et al., 2011). Sua presença no ictioplâncton é registrada, na maioria dos casos, em ambientes com características lênticas e as grandes abundâncias registradas nesses estudos podem ser atribuídas ao tipo de desenvolvimento inicial, como ovos e larvas pelágicos, que favorecem a dispersão na superfície (BIALETZKI et al., 2004; KIPPER et al., 2011). Como expostas anteriormente, as características do Baixo Itapecuru podem estar favorecendo a reprodução desta espécie e o seu desenvolvimento inicial, evidenciado pela captura elevada de larvas na área amostrada.
Na área amostrada, foram identificadas larvas de 12 espécies de peixes de importância comercial e três espécies endêmicas para a região do nordeste do Brasil (Schizodon dissimilis, Triportheus signatus e Prochilodus lacustris). Das espécies de importância comercial, as maiores densidades foram registradas para Plagioscion squamosissimus, Ageneiosus aff. ucayalensis, Hoplias malabaricus e Pseudauchenipterus nodosus (Tabela 1). Barros et al. (2011), em levantamento realizado sobre a ictiofauna do rio Itapecuru, identificaram 55 espécies no seu trecho inferior, de um total de 69 encontradas em todo o percurso fluvial analisado, das quais 30% são consideradas endêmicas para o nordeste brasileiro. O número de táxons encontrados ressalta a importância ecológica do ambiente estudado, demonstrando, assim, a necessidade de sua conservação.
Espécies migradoras de curta distância estiveram representadas por larvas de Leporinus cf. friderici e Rhamdia sp.. Além destas, foram amostradas larvas de espécies de peixes migradores de longa distância, Prochilodus lacustris, Pimelodus blochii e Sorubim lima. Espécies de longa migração, geralmente, apresentam desova total, curto período reprodutivo, ovos pequenos, ausência de cuidado parental e longos deslocamentos durante a reprodução (SUZUKI et al., 2005). A presença destas espécies no Baixo Itapecuru demonstra a utilização de áreas à montante para a reprodução, com deriva das larvas rio abaixo, até encontrarem ambientes adequados ao seu desenvolvimento.
Das famílias, as maiores frequências de captura foram registradas para larvas de Characidae, Sciaenidae e Auchenipteridae nos pontos ITA-P01 e ITA-P02. No ponto ITA-P03, larvas de Doradidae foram mais frequentes, seguida de Sciaenidae e Auchenipteridae. Pode-se verificar também que, no gradiente longitudinal do ponto 1 ao 3, ocorre um decréscimo, principalmente, na captura de larvas de Characidae, Sciaenidae e demais famílias de Characiformes (Figura 2).
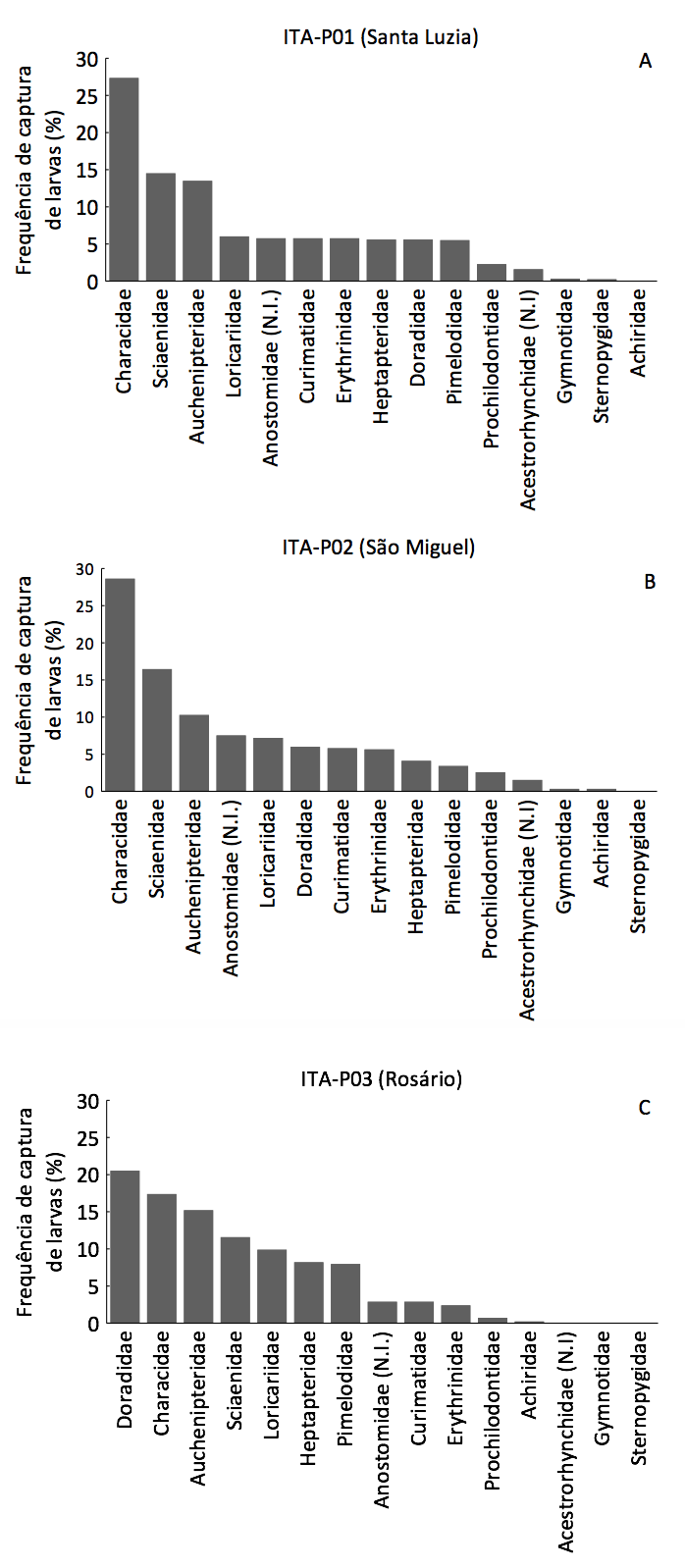
Figura 2. Frequência das larvas de peixes, por família, coletadas trimestralmente,
no período de maio de 2012 a outubro de 2014, no Baixo Itapecuru (Maranhão, Brasil).
(N.I. – Não-Identificada).
Considerando-se a densidade média, verifica-se que os maiores valores foram observados no ponto 1 (ITA-P01) e os mais baixos no ponto 3 (ITA-P03) (Figura 3A). No ponto 1, destaque para larvas de Characidae (5,51 ± 2,32 larvas/10 m3), Plagioscion squamosissimus (4,23 ± 1,21 larvas/10 m3), Characiformes (3,87 ± 1,64 larvas/10 m3), Siluriformes (2,80 ± 2,13 larvas/10 m3), Perciformes (2,81 ± 0,81 larvas/10 m3), Ageneiosus aff. ucayalensis (2,77 ± 1,38), Hoplias malabaricus (2,41 ± 1,99 larvas/10 m3) e Doradidae (2,35 ± 1,08 larvas/10 m3). No ponto 3, as maiores médias foram de larvas de Siluriformes (2,41 ± 1,37 larvas/10 m3) e Doradidae (2,09 ± 1,06 larvas/10 m3) (Tabela 1).
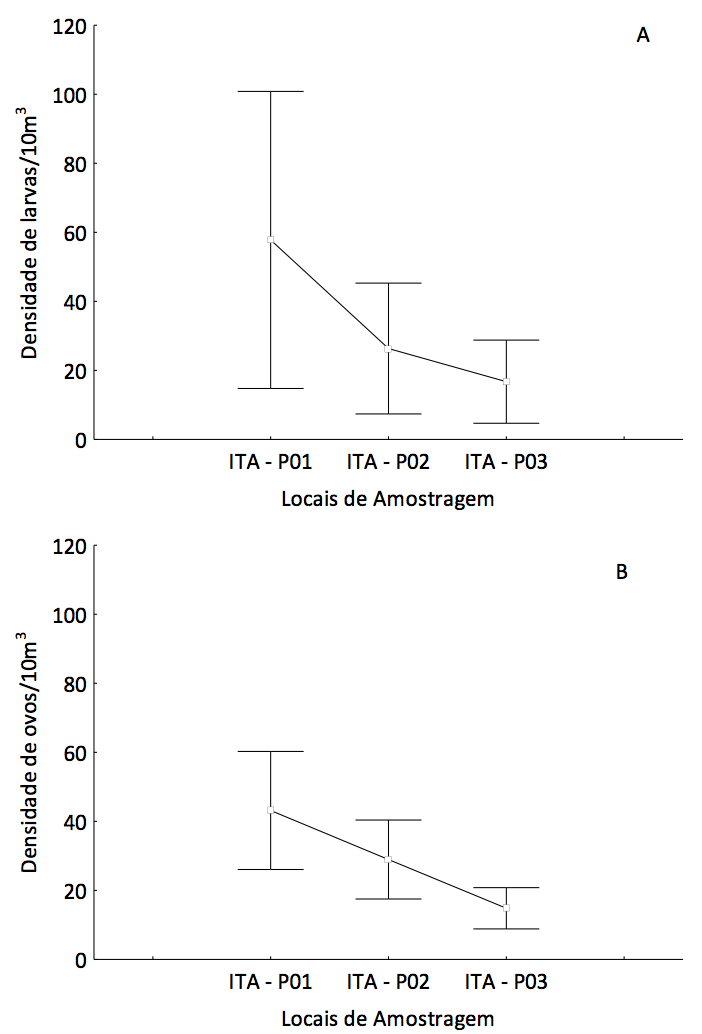
Figura 3. Densidade média de larvas (A) e ovos (B) de peixes coletados, trimestralmente,
no período de maio de 2012 a outubro de 2014, no Baixo Itapecuru (Maranhão, Brasil).
(círculos = valor médio; barras = erro padrão).
A diferença espacial observada nos valores de densidade e na frequência de captura de larvas no sentido montante-jusante (do Ponto 1 ao ponto 3), podem estar associados a diferenças ambientais, não abordadas nesse estudo. De acordo com ALCÂNTARA (2004) e MMA (2006), no baixo curso do rio Itapecuru, nas proximidades da cidade de Rosário, observa-se a mistura de água doce/água salgada, proveniente da intrusão de água marinha vinda da Baía do Arraial (foz), embora em baixa intensidade. Dessa forma, os pontos 1 (Santa Luzia) e 2 (São Miguel), por estarem mais distantes da foz, não sofrem os efeitos da maré dinâmica e da cunha salina, limitando a distribuição dos Characiformes, principalmente dos caracídeos, e de P. squamosissimus, espécies predominantemente de ambientes dulcícolas. A influência de tais fatores no ambiente, mesmo que em baixa intensidade, pode afetar a distribuição e abundância das larvas de peixes nos diferentes habitats de um sistema (OOI; CHONG, 2011; SARPEDONTI et al., 2013; GOMES et al., 2014).
A ocorrência de ovos foi verificada em todos os locais de amostragem (Figura 3B), em sua maioria no período chuvoso (janeiro a maio) (Figura 4), indicando que esse trecho do rio também está sendo utilizado para desovas de algumas espécies de peixes.
Considerando todo o período de estudo, 52,98% das capturas de ovos ocorreram no ponto ITA-P01 (52,98%), seguido de 31,93% no ponto ITA-P02 e 15,09% no ponto ITA-P03. As maiores densidades médias foram registradas na região à montante da área de estudo (ponto ITA-P01) (Figura 3). Vários autores tem reportado a presença de ovos e larvas durante o ano todo, mas com incremento considerável nas capturas durante os períodos de elevação do nível da água, causado pelas chuvas (BIALETSKI et al., 2005; TONDATO et al., 2010; REYNALTE-TATAJE et al., 2012a, b).
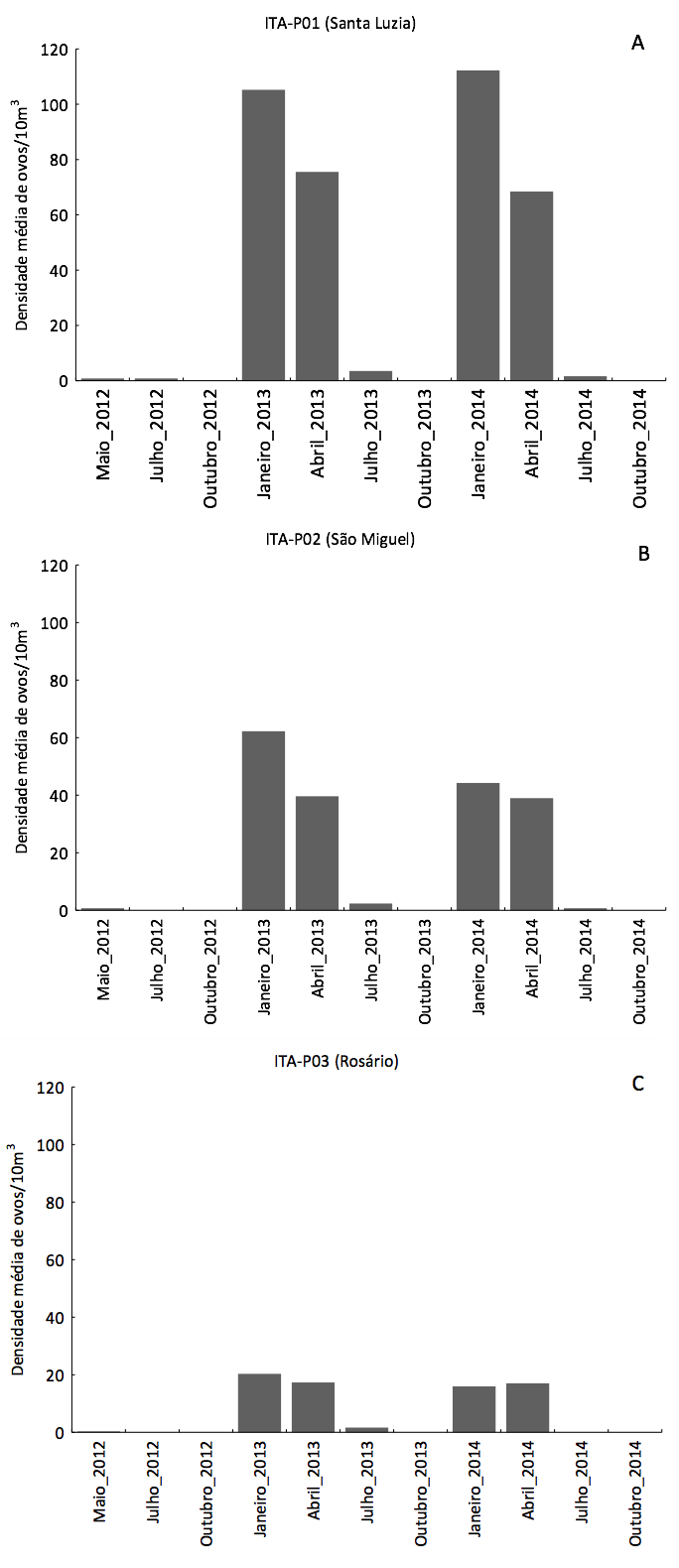
Figura 4. Distribuição espacial de ovos de peixes coletados, trimestralmente,
no período de maio de 2012 a outubro de 2014, no Baixo Itapecuru (Maranhão, Brasil).
A Análise de Variância (ANOVA), aplicada sobre os dados de densidade, permitiu identificar diferenças significativas apenas na abundância anual média das larvas [F(2, 30) = 3,76; p < 0,05 (Figura 5A)], cujos maiores valores foram verificados no ponto ITA-P01 (Tukey; p < 0,05). A densidade de ovos não apresentou diferenças significativas entre os locais de amostragem, embora se tenha verificado uma tendência de decréscimo longitudinal no sentido montante-jusante [ITA-P01 (Santa Luzia) – ITA-P03 (Rosário)] (Figura 5B). Ao longo desse gradiente, provavelmente, os ovos provenientes de desovas mais a montante foram eclodindo e as larvas recém-eclodidas se desenvolvendo à medida que estavam derivando no canal principal do rio. Resultados semelhantes foram encontrados por outros autores (GOGOLA et al. 2010; SILVA et al., 2011), que observaram a existência de um gradiente longitudinal, sendo os ovos mais abundantes nas áreas à montante dos rios, diminuindo em direção à foz.
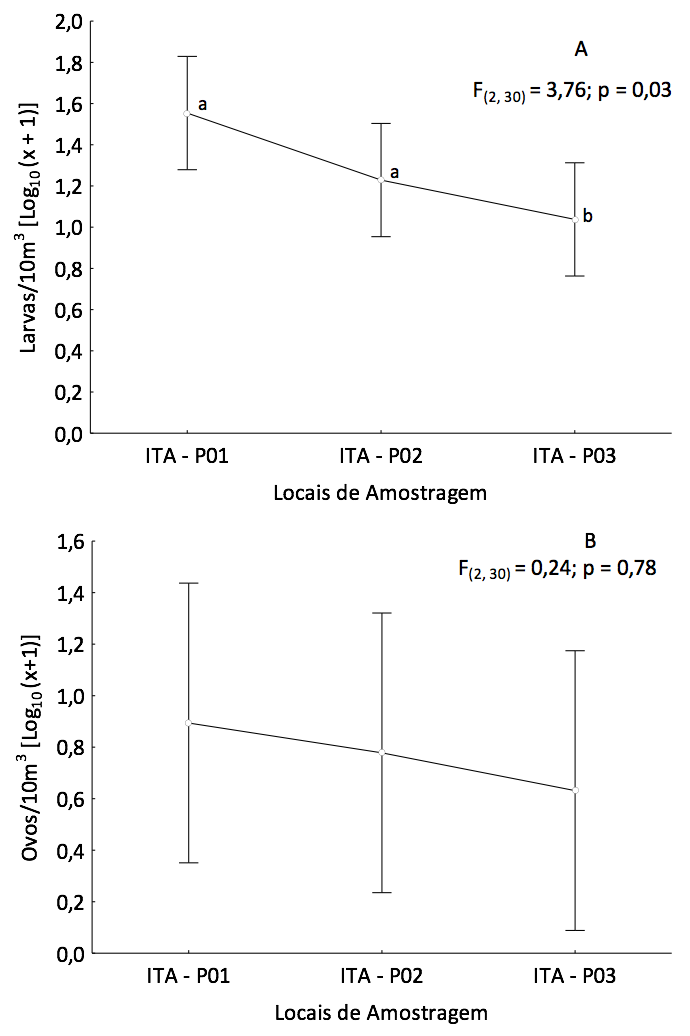
Figura 5. ANOVA unifatorial aplicada aos dados de densidade [log10 (x +1)] de larvas (A)
e ovos (B) de peixes coletados, trimestralmente, no período de maio de 2012
a outubro de 2014, no Baixo Itapecuru (Maranhão, Brasil). (x = densidade;
círculos = valor médio; barras= erro padrão). Letras diferentes sobre as barras
representam diferenças temporais significativas (Tukey p<0,05).
Os registros produzidos até aqui constituem um marco importante na investigação das fases iniciais de desenvolvimento das espécies de peixes, agregando informações ao conhecimento da dinâmica da ictiofauna do trecho inferior do rio Itapecuru. A assembleia de larvas amostrada esteve composta principalmente por espécies de peixes de pequeno e médio porte, pertencentes às ordens Characiformes e Siluriformes. Os 21 táxons identificados em nível específico correspondem a aproximadamente 38% do total de espécies reconhecidas para a região, sendo três consideradas endêmicas para o nordeste do Brasil (Schizodon dissimilis, Triportheus signatus e Prochilodus lacustris) e 12 de importância comercial. Ovos de peixes também foram encontrados no Baixo Itapecuru indicando que esse trecho do rio também está sendo utilizado para desovas de algumas espécies de peixes.
À Universidade Federal do Maranhão (UFMA), por disponibilizar a infraestrutura necessária para a coleta e análise do material biológico; aos técnicos do Laboratório de Ictiologia do Departamento de Oceanografia e Limnologia (DEOLI/UFMA), pela coleta do material em campo e à FAPEMA (Fundação de Amparo à Pesquisa e ao Desenvolvimento Científico do Maranhão) pela concessão da bolsa de Doutorado do primeiro autor.
AGOSTINHO, Â. A.; GOMES, L. C.; VERÍSSIMO, S.; OKADA, E. K. Flood regime, dam regulation and fish in the Upper Paraná river: effects on assemblage attributes, reproduction and recruitment. Reviews in Fish Biology and Fisheries. V. 14, n. 1, p. 11-19, 2004.
ALCÂNTARA, E. H. Caracterização da bacia hidrográfica do rio Itapecuru, Maranhão-Brasil. Caminhos de Geografia, v. 7, n. 11, p. 97-113, 2004.
ANDRADE, N, P. Estrutura do ictioplâncton no estuário do Porto de Icatu - MA: bases para o reconhecimento de áreas de desovas e crescimento de espécies de interesse pesqueiro. 2006. 66f. Monografia (Bacharelado) Universidade Federal do Maranhão/UFMA, São Luís, 2006.
ARANHA, F. J. Caracterização sócio-econômica e ambiental da bacia do rio Itapecuru no pico da seca, Maranhão. São Luís: DEGEO, 1997.
ARAÚJO, A. de; PESSOA, C. R. D.; FERREIRA-CORREIA, M. M.; IBAÑEZ, M. do S.R. Fitoplâncton do Rio Itapecuru, Maranhão, Brasil: uma contribuição ao seu conhecimento. Boletim do Laboratório de Hidrobiologia, v. 11, p. 25-35, 1998.
ARAÚJO-LIMA, C. A. R. M.; OLIVEIRA, E. C. Transport of larval fish in the Amazon. Journal os Fish Biology, v. 53 (Supplement A), p. 297-306, 1998.
ÁVILA-SIMAS, S.; REYNALTE-TATAJE, D. A.; ZANIBONI-FILHO, E. Pools and rapids as spawning and nursery areas for fish in a river stretch without floodplains. Neotropical Ichthyology, v.12, n.3, p. 611-622, 2014.
AZEVEDO, M. A. Reproductive characteristics of characid fish species (Teleostei, Characiformes) and their relationship with body size and phylogeny. Iheringia, v. 100, n 4, p. 469–482, 2010.
BARROS, M. C.; FRAGA, E.C.; BIRINDELLI, J.L.O. Fishes from the Itapecuru River basin, State of Maranhão, northeast Brazil. Brazilian Journal of Biology, v. 71, n. 2, p. 375-380, 2011.
BARZOTTO, E. ; SANCHES, P. V.; BIALETZKI, A.; ORVATI, L.; GOMES, L. C. Larvae of migratory fish (Teleostei: Ostariophysi) in the lotic remnant of the Paraná River in Brazil. Zoologia, v. 32, p. 270-280, 2015.
BENNEMANN, S. T.; SHIBATTA, O.; GARAVELLO. Peixes do rio Tibagi: uma abordagem ecológica. Londrina: Editora da Universidade Estadual de Londrina, 2000.
BIALETZKI, A., NAKATANI, K., SANCHES, P.V.; BAUMGARTNER, G. Eggs and larvae of the ‘curvina’ Plagioscion squamosissimus (Heckel, 1840) (Osteichthyes, Sciaenidae) in the Baía River, Mato Grosso do Sul State, Brazil. Journal of Plankton Research, v. 26, p. 1327-1336, 2004.
BIALETSKI, A.; NAKATANI, K.; SANCHES, P. V.; BAUMGARTNER, G.; GOMES, L. C. Larval fish assemblage in the Baía River (Mato Grosso do Sul State, Brazil): temporal and spatial patterns. Environmental Biology of Fishes, v. 73, p. 37-47, 2005.
DAGA, V. S.; GOGOLA, T. M; SANCHES, P. V.; BAUMGARTNER, D.; PIANA, P. A.; GUBIANI, E. A.; DELARIVA, R. L. Fish larvae assemblages in two floodplain lakes with different degrees of connection to the Paraná River, Brazil. Neotropical Ichthyology, v. 7, n. 3, p. 429-438, 2009.
GOGOLA, T. M; DAGA, V. S.; SILVA, P. R. L. da; SANCHES, P. V.; GUBIANI, E. A.; BAUMGARTNER, D.; DELARIVA, R. L. Spatial and temporal distribution patterns of ichthyoplankton in a region affected by water regulation by dams. Neotropical Ichthyology, v. 8, n. 2, p. 341-349, 2010.
GOGOLA, T. M.; SANCHES, P. V. ; GUBIANI, É. A.; DA SILVA, P. R. L. Spatial and temporal variations in fish larvae assemblages of Ilha Grande National Park, Brazil. Ecology of Freshwater Fish, v. 22, p. 95-105, 2013.
GOMES, E.A.P., CAMPOS, P.N., BONECKER, C.T. Occurrence of Gobiidae larvae in a tropical Brazilian estuary, with particular emphasis on the use of size classes to categorize species guilds. Journal of Fish Biology, v. 84, p. 996 – 1013, 2014.
HARE, J. A.; RICHARDSON, D. E. The use of early life stages in stock identification studies. In: CADRIN, S. X.; KERR, L. A.; MARIANI, S. (Ed.) Stock Identification Methods. New York: Academic Press, 2014 p. 329-364.
HOUDE, E. D. Emerging from Hjort’s shadow. Journal of Northwest Atlantic Fishery Science, v. 41, p. 53–70, 2008.
JURAS, I. da A. G. M. Levantamento bioecológico na área de influência da Indústria de alumínio do Consórcio ALUMAR na Ilha de São Luís - MA. Relatório técnico. São Luís: UFMA/LABOHIDRO, p. 209-220, 1983.
JURAS, I. da A. G. M. Levantamento bioecológico na área de influência da Industria de Alumínio do Consórcio ALUMAR na Ilha de São Luís - MA. Relatório técnico. São Luís: UFMA/LABOHIDRO, p. 109-189, 1984.
JURAS, I. da A. G. M. Levantamento bioecológico na área de influência da Industria de Alumínio do Consórcio ALUMAR na Ilha de São Luís - MA. Relatório técnico. São Luís: UFMA/LABOHIDRO, p. 190-260, 1985.
KING, A. Density and distribution of potential prey for larval fish in the channel of a floodplain river: pelagic versus epibenthic meiofauna. River Research and Aplications, v. 20, p. 883-897, 2004.
KIPPER, D.; BIALETZKI, A.; SANTIN, M. Composição taxonômica da assembleia de larvas de peixes no reservatório de Rosana, Rio Paranapanema, Brasil. Biota Neotropica, v. 11, p. 421-426, 2011.
KIPPER, D.; TAGUTI, T. L.; BIALETZKI, A.; MAKRAKIS, M. C.; BAUMGARTNER, G.; SANCHES, P. V. Early ontogeny of Clarias gariepinus (Siluriformes, Clariidae) and aspects of its invasion potential in natural freshwater environments. Acta Scientiarum, v. 35, p. 411-418, 2013.
LEITE, R. G.; SILVA, J. V. V.; FREITAS, C. E. Abundância e distribuição das larvas de peixes no Lago Catalão e no encontro dos rios Solimões e Negro, Amazonas, Brasil. Acta Amazonica, v. 36, n. 4, p. 557-562, 2006.
LIMA, A. C. de; ARAÚJO-LIMA, C.A.R.M. The distribution of larval and juvenile fishes in Amazonian rivers of different nutrient status. Freshwater Biology, v. 49, p. 787-800, 2004.
MENEZES, N. A.; WEITZMAN, S. E.; OYAKAWA, O. T.; LIMA, F. C.; CASTRO, R. M. C. C.; WEITZMAN, M. J. Peixes de água doce da Mata Atlântica. São Paulo: Museu de Zoologia da USP, 2007.
MMA. Ministério do Meio Ambiente. 2006. Caderno da Região Hidrográfica Atlântico Nordeste Ocidental. Obtido em http:// http://www.mma.gov.br/estruturas/161/_publicacao/161_publicacao03032011024629.pdf (Acessado em 14/12/2015).
NAKATANI, K.; AGOSTINHO, A. A.; BAUMGARTNER, G.; BIALETZKI, A.; SANCHES, P. V.; MAKRAKIS, M. C.; PAVANELLI, C. S. Larvas de peixes de água doce: desenvolvimento e manual de identificação. Maringá: EDUEM, 2001.
NASCIMENTO, F. L.; NAKATANI, K. Relações entre fatores ambientais e a distribuição de ovos e larvas de peixes na sub-bacia do rio Ivinhema, Estado de Mato Grosso do Sul, Brasil. Acta Scientiarum, v. 28, n. 2, p. 117-122, 2006.
OLIVEIRA, E. C.; FERREIRA, E. J. G. Spawning areas, dispersion and microhabitats of fish larvae in the Anavilhanas Ecological Station, rio Negro, Amazonas State, Brazil. Neotropical Ichthyology, v. 6, n. 4, p. 559-566, 2008.
OOI, A.L.; CHONG, V.C. Larval Fish assemblages in a tropical mangrove estuary and adjacent coastal Waters: offshore-inshore flux of marine and estuarine species. Continental Shelf Research, v. 31, p. 1599–1610, 2011.
OYAKAWA, O. T.; AKAMA, A.; MAUTARI, K. C.; NOLASCO, J. C. Peixes de riachos da Mata Atlântica. São Paulo: Editora Neotropica, 2006.
PIORSKI, N. M.; CASTRO, A. C. L.; PEREIRA, L. G.; MUNIZ, M. E. L.Ictiofauna do trecho inferior do rio Itapecuru, Nordeste do Brasil. Boletim do Laboratório de Hidrobiologia, v. 11, p. 15-24, 1998.
REIS, R. E.; KULLANDER, S. O.; FERRAIS JR., C. J. Check list of the freshwater fishes of South and Central America. Porto Alegre: EDIPUCRS, 2003.
REYNALTE-TATAJE, D. A. 2007. Influência inter e intra anual de variáveis ambientais sobre a estrutura da comunidade ictioplanctônica em duas bacias hidrográficas brasileiras. 2007. 116ff. Tese (Doutorado). Universidade Estadual de Maringá/UEM, Maringá. 2007.
REYNALTE-TATAJE, D. A.; SILVA, S. H.; SILVA, P. A.; BIALETZKI, A.; ZANIBONI-FILHO, E. Locais de crescimento de larvas de peixes na região do Alto Rio Uruguai (Brasil). In: ZANIBONI-FILHO, E.; NUÑER, A. P. O. (Ed.). Reservatório de Itá: estudos ambientais, desenvolvimento de tecnologias de cultivo e conservação da ictiofauna. Florianópolis: Editora UFSC, 2008. p. 159-194.
REYNALTE-TATAJE, D. A.; NAKATANI, K.; FERNANDES, R.; AGOSTINHO, A. A.; BIALETZKI, A. Temporal distribution of ichthyoplankton in the Ivinhema River (Mato Grosso do Sul State/Brazil): influence of environmental variables. Neotropical Ichthyology, v. 9, p. 427-436, 2011.
REYNALTE-TATAJE, D. A.; NUÑER, A. P. O.; NUNES, M. C.; GARCIA, V.; LOPES, C. A.; ZANIBONI-FILHO, E. Sapwning of migratory fish species between two reservoirs of the upper Uruguay River, Brazil. Neotropical Ichthyology, v. 10, p. 829-835, 2012a.
REYNALTE-TATAJE, D. A.; ZANIBONI-FILHO, E.; BIALETZKI, A.; AGOSTINHO, A. A. Temporal variability of fish larvae assemblages: influence of natural and anthropogenic disturbances. Neotropical Ichthyology, v. 10, n. 1, p. 837-846, 2012b.
REYNALTE-TATAJE, D. A.; AGOSTINHO, A. A.; BIALETZKI, A. Temporal and spatial distributions of the fish larval assemblages of the Ivinheima River sub-basin (Brazil). Environmental Biology of Fishes, v. 96, p. 811-822, 2013.
SARPEDONTI, V.; ANUNCIAÇÃO, E.M.S.; BORDALO, A.O. Spatio-temporal distribution of fish larvae in relation to ontogeny and water quality in the oligohaline zone of a North Brazilian estuary. Biota Neotropica, v. 13, p. 55–63, 2013.
SILVA, P. S.; ASSUMPÇÃO, L.; LIMA, A. F.; MAKRAKIS, M. C.; MAKRAKIS, S.; DIAS, J. H. P. Distribuição espacial e temporal de ovos e larvas de peixes no rio Aguapeí SP, Alto Rio Paraná. Fórum Ambiental da Alta Paulista, v. 7, p. 1-10, 2011.
SILVA, D. de J.; CONCEIÇÃO, G. M. da. Rio Itapecuru: Caracterização Geoambiental e Socioambiental, Município de Caxias, Maranhão, Brasil. Scientia Plena, v. 7, n. 1, p. 1-26, 2011.
SILVEIRA, P. C. A. da. Ictionêuston da Zona Econômica Exclusiva referente ao Estado do Maranhão (Região Norte do Brasil). 2003. 53f. Dissertação (Mestrado) Universidade Federal de Pernambuco/UFPE, Recife, 2003.
SOARES, R. D. B.; CUTRIM, M. V. J.; SILVEIRA, P. C. A. da. Comunidade ictioplanctônica da bacia hidrográfica do rio Bacanga na cidade de São Luís, Maranhão, Brasil. Revista de Ciências Ambientais, v. 8, n. 1, p. 37-48, 2014.
STRATOUDAKIS, Y.; BERNAL, M.; KONSTANTINOS, G.; URIATE, A. The daily egg production method: recent advances, current applications and future challenges. Fish and Fisheries, v. 7, p. 35–57, 2006.
SUZUKI, H.I., BULLA, C.K.; AGOSTINHO, A.A. Estratégias reprodutivas de assembleias de peixes em reservatórios. In: RODRIGUES, L.; THOMAZ, S.M.; AGOSTINHO, A.A.; GOMES, L.C. (Ed.). Biocenoses em Reservatórios: padrões espaciais e temporais. São Carlos: RiMa, 2005. p. 223-236.
TAGUTI, T. L.; BIALETZKI, A.; SEVERI, W.; AGOSTINHO, A. A.; ASSAKAWA, L. F. Early development of two tropical fishes (Perciformes: Sciaenidae) from the Pantanal of Mato Grosso, Brazil. Revista de Biologia Tropical, v. 63, p. 1105-1118, 2015.
TANAKA, S. Stock assessment by means ichthyoplankton surveys. FAO Fisheries Technical Paper, v. 122, p. 33-51, 1973.
TONDATO, K. K.; MATEUS, L. A. de F.; ZIOBER, S. R. Spatial and temporal distribution of fish larvae in marginal lagoons of Pantanal, Mato Grosso State, Brazil. Neotropical Ichthyology, v. 8, n. 1, p. 123-134, 2010.
ZACARDI, D. M. Variação e abundância do ictioplâncton em canais de maré no Extremo Norte do Brasil. Biota Amazônia, v. 5, n. 1, p. 43-52, 2015.
ZAR, J. H. Biostatistical analysis. New Jersey: Prentice Hall, 1999.
ZIOBER, S. R.; BIALETZKI, A.; MATEUS, L. A. de F. Effect of abiotic variables on fish eggs and larvae distribution in headwaters of Cuiabá river, Mato Grosso State, Brazil. Neotropical Ichthyology, v. 10, n. 1, p. 123-132, 2012.
1. Doutoranda em Ciências Ambientais (LABOMAR/Universidade Federal do Ceará - UFC), Professora do Instituto Federa do Maranhão (IFMA). *Autor para correspondência. E-mail: ecsdourado@ifma.edu.br
2. Departamento de Oceanografia e Limnologia, Universidade Federal do Maranhão (UFMA). E-mail: alec@ufma.br
3. Instituto de Ciências do Mar (LABOMAR), Universidade Federal do Ceará (UFC). E-mail: oscarinasousa@yahoo.com.br
4. Instituto de Ciências do Mar (LABOMAR), Universidade Federal do Ceará (UFC). E-mail: rcruzizquierdo@gmail.com