

Vol. 38 (Nº 44) Año 2017. Pág. 26
Taise Cristina Plattau ARENHARDT 1; Guilherme Alan KLUNK 2; Eduardo ADENESKY FILHO 3; Marcelo Diniz VITORINO 4
Recibido: 11/05/2017 • Aprobado: 21/06/2017
RESUMO: O objetivo deste estudo foi avaliar a influência de técnicas de restauração nos artrópodes de serapilheira, coletados com armadilhas pitfall e funil de Berlese-Tüllgren. No período de agosto/2014 a agosto/2015, bimestralmente, foram coletados um total de 121.213 artrópodes (Collembola e Insecta). As análises permitiram comparações da floresta nativa com diferentes técnicas de nucleação a fim de verificar as mudanças que ocorrem ao longo do tempo em áreas sob processo de restauração, além da identificação de potenciais famílias bioindicadoras. |
ABSTRACT: The objective of this study was to evaluate the influence of restoration techniques on litter arthropods collected with pitfall traps and Berlese-Tüllgren funnels. From august/2014 to august/2015 bimonthly, a total of 121,213 arthropods (Collembola and Insecta) were collected. The data analyses allowed comparisons of the native forest and different nucleation techniques to verify the changes occurring over the time in areas under restoration, besides the identification of potential bioindicator families. |
Alterações antrópicas nos ecossistemas naturais tem sido uma atividade frequente, trazendo consequências negativas para a biodiversidade (TABARELLI et al. 2012). No Bioma Mata Atlântica, essas alterações tiveram início no período da colonização (SCHÄEFFER e PROCHNOW, 2002) e ocorrem até os dias atuais. Diante desta situação, nas últimas décadas diversas iniciativas de restauração de áreas degradadas têm sido propostas a partir da aplicação de diferentes técnicas, com o objetivo de diminuir as consequências da degradação ambiental (REIS et al. 2003; MARTINS, 2012), notadamente em Unidades de Conservação.
O Parque Nacional da Serra do Itajaí (PNSI) é uma Unidade de Conservação de Proteção Integral localizada no Vale do Itajaí, no estado de Santa Catarina, sul do Brasil. Possui uma área total de 57.347 hectares, dos quais 1.453 hectares encontram-se degradados devido às atividades de agricultura e pecuária (BRASIL, 2009). O Projeto Restaurar, desenvolvido pela Universidade Regional de Blumenau tem como objetivo restaurar 300 hectares de áreas degradadas do PNSI a partir da implantação de diferentes técnicas de nucleação, de plantios de espécies nativas e do monitoramento de diferentes grupos de fauna. Entre estes grupos, estão sendo monitorados os artrópodes de serapilheira, notadamente os da Classe Insecta, pois estes raramente são incluídos no monitoramento de áreas degradadas, mesmo tendo o conhecimento do potencial bioindicador deste grupo faunístico.
A fauna de invertebrados constitui-se no mais diverso grupo da fauna do solo, desempenhando papéis fundamentais em diversos processos ecológicos, principalmente no que diz respeito à participação direta e/ou indireta na decomposição da matéria orgânica (MORAIS et al. 2013). Sua utilização no monitoramento de técnicas de restauração de áreas degradadas pode ser eficiente uma vez que efeitos no meio ambiente podem ocasionar alterações na diversidade, equitabilidade e composição desses organismos (LOUZADA e ZANETTI, 2013).
O objetivo deste trabalho foi avaliar e quantificar a influência de diferentes técnicas de restauração na abundância e composição de artrópodes de serapilheira na área do Faxinal do Bepe no Parque Nacional da Serra do Itajaí, em Santa Catarina, Brasil.
O Parque Nacional da Serra do Itajaí (PNSI) é uma Unidade de Conservação de Proteção Integral, localizada na região do Vale do Itajaí no Estado de Santa Catarina, abrangendo nove municípios. Possui área total de 57.374 mil hectares de floresta nativa das quais 1.453 hectares encontram-se degradados. No interior do parque está localizada uma área denominada Faxinal do Bepe, com 300 hectares, em elevado grau de antropização, devido à conversão da floresta nativa em áreas de pastagem e agricultura (Figura 1). O PNSI pertence à bacia hidrográfica do rio Itajaí-açú e abriga diversas nascentes responsáveis pelo abastecimento de cerca de um milhão de habitantes do Vale do Itajaí (BRASIL, 2009).
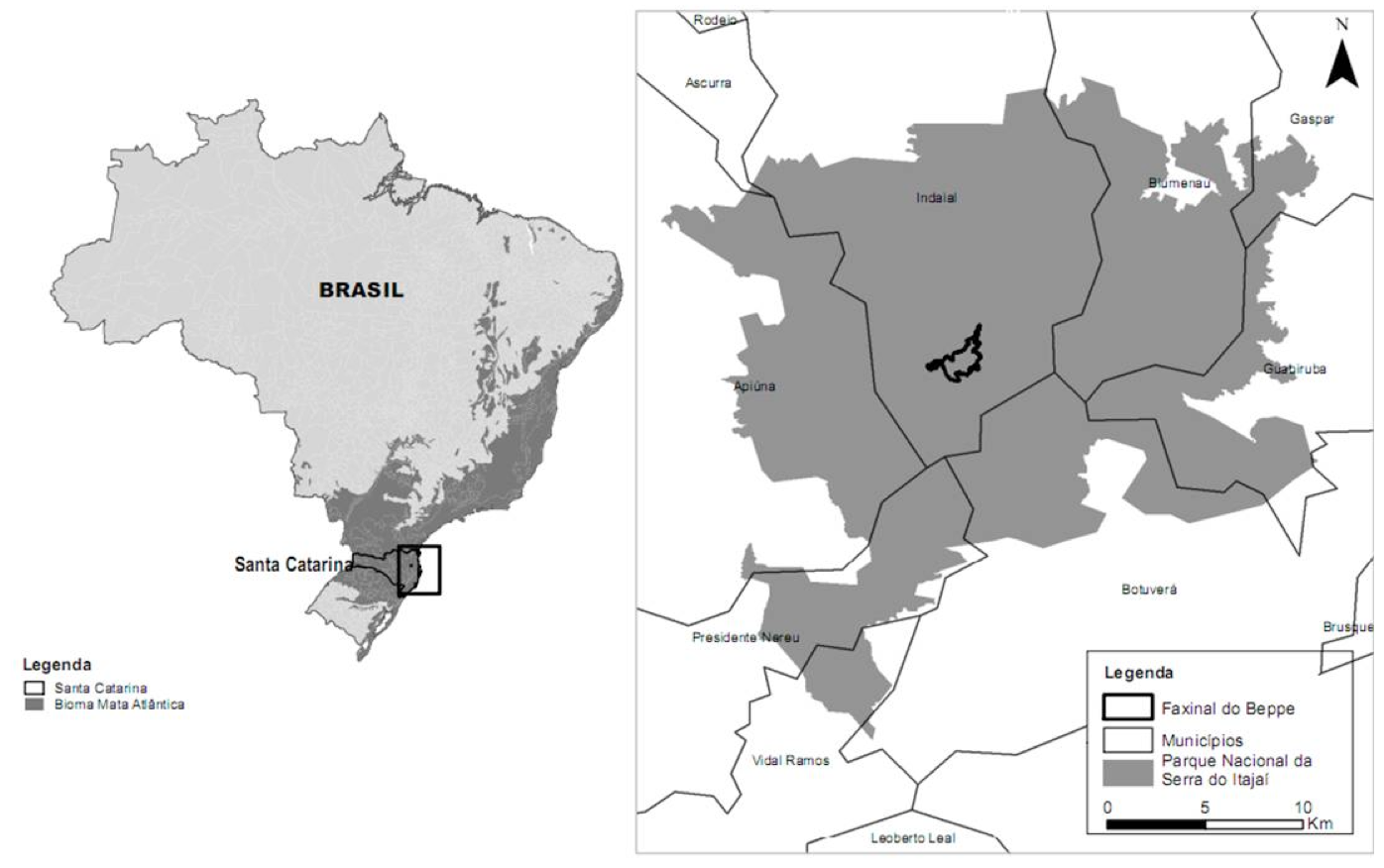
Figura 1. Localização do Faxinal do Bepe no Parque Nacional da Serra do Itajaí, Santa Catarina, Brasil.
Figure 1. Faxinal do Bepe area in the National Park from Serra do Itajaí, Santa Catarina, Brazil.
Foram selecionadas quatro áreas amostrais: floresta nativa (referência), rugosidades no solo, poleiros artificiais e transposição de galharia.
Floresta nativa: Pertence à fitofisionomia Floresta Ombrófila Densa Montana, com altitudes que variam de 600 a 800 metros (BRASIL, 2009). Em levantamentos realizados na área, as principais espécies vegetais identificadas, em ordem decrescente de valor de importância (VI), foram Cyathea phalerata Mart. (Cyatheaceae), Alsophila setosa Kaulf.(Cyatheaceae), Alchornea triplinervea Spreng. Müll. Arg. (Euphorbiaceae), Dicksonia sellowiana Hook. (Dicksoniaceae), Cedrela fissilis Vell. (Meliaceae), Ocotea puberula Rich. Nees. (Lauraceae), Guatteria australis A.St.-Hil. (Annonaceae), Vernonanthura discolor Spreng. H.Rob. (Asteraceae) e Ocotea elegans Mez (Lauraceae).
Rugosidades no solo: Técnica de nucleação, instalada em uma área de pastagem limpa, que consiste na criação de pequenas variações no relevo, alternando superfícies côncavas e convexas, que aumentam a variabilidade de micro-habitat, ocasionando maior possibilidade de colonização por um maior número de espécies e retenção da água da chuva por mais tempo (AUMOND, 2003). Cada rugosidade possui dimensões de 0,4 metros de profundidade, 2,0 metros de comprimento e 0,3 metros de largura, distanciados 4 metros entre si, totalizando 625 rugosidades por hectare.
Poleiros artificiais: Técnica de nucleação, instalada em uma área de pastagem. Neste ambiente foram encontrados indivíduos regenerantes de Critoniopsis quinqueflora (Less.) H. Rob. (Asteraceae), Piptocarpha axillaris Less. Baker (Asteraceae), Vernonanthura discolor Spreng. H.Rob. (Asteraceae) e Miconia tristis Spring. (Melastomataceae). A técnica visa à criação de ambientes adequados para a atração e pouso de aves que são responsáveis pela dispersão de sementes de diversas espécies, tornando-se uma forma de atrair sementes para a área que está degradada (REIS et al. 2003). Cada poleiro foi constituído por uma escora de eucalipto de 5,0 metros de comprimento, enterrada 0,5 metro no solo. Na parte superior foram introduzidos bambus de 1,5 metros de comprimento, que servem como galhos para o pouso das aves. Foram instalados, de forma aleatória, 20 poleiros por hectare, totalizando 240 poleiros.
Transposição de galharia: Técnica de nucleação, instalada em área de pastagem com a presença de nascentes e mata ciliar, que consistiu na instalação de galharias composta por restos vegetais que formam núcleos de biodiversidade servindo de abrigo para nidificação e alimentação de animais (REIS et al. 2003). Foram instalados 80 módulos por hectare, totalizando 160 módulos, distribuídos de forma equidistante com distância de aproximadamente 11 metros entre cada um. Cada módulo ocupa uma área de aproximadamente 2 m x 2 m (4 m²), recobrindo uma área de 320 m² por hectare.
As coletas dos artrópodes de serapilheira foram realizadas no período de agosto de 2014 até agosto de 2015, bimestralmente, totalizando sete coletas. A amostragem consistiu na instalação de transectos de 100 metros nas áreas amostrais e permaneceram em campo por um período de três noites. Em cada transecto foram instaladas cinco armadilhas do tipo pitfall ao nível do solo e preenchidas com 200 ml de água, 10 ml de álcool 70% e 5 ml de detergente biodegradável, dispostas a cada 20 metros uma da outra. A função do álcool é de preservar o material durante o período em que a armadilha estiver em campo e a do detergente de quebrar a tensão superficial da água.
Foram retirados duas amostras de serapilheira aleatoriamente (0,5 m2 cada amostra) ao longo de cada transecto, as quais foram depositadas em funis de Berlese-Tüllgren para extração dos artrópodes, totalizando, portanto, 1,0 m2 por transecto por bimestre. Os funis de Berlese-Tüllgren foram montados no LAMPF (Laboratório de Monitoramento e Proteção Florestal) sendo o material advindo das amostras da serapilheira triados por 14 dias sob lâmpadas incandescentes com potência de 60 watts acesas 24 horas por dia. Foi instalado 1 (um) transecto em cada área amostral e, em cada coleta, os transectos foram instalados em locais diferentes no interior da área amostral para conhecimento de dados da distribuição espacial.
Todos os insetos coletados foram triados, contados, identificados ao nível de ordem e família, etiquetados e acondicionados em recipientes separados por área amostral, tipo de armadilha e data da coleta.
Foram considerados dados das Classes Insecta e Collembola. Os dados coletados foram analisados visando comparar a área de floresta nativa com as técnicas nucleadoras, através de dados de frequência relativa, limite de dominância, índice de diversidade e de similaridade.
A frequência relativa (F%) foi determinada através da seguinte equação (SILVEIRA NETO, 1976): F(%) = N/T*100, onde: F = frequência (%); N = total de indivíduos de cada espécie amostrada; T = total de indivíduos amostrados. A dominância foi determinada a partir da equação do limite de dominância (LD) citada por Sakagami; Laroca (1971) e Lutinski; Garcia (2005): LD = 1/S*100, onde: LD = limite de dominância; S: número total de famílias da amostra. As famílias/ordens que apresentaram frequência relativa superior ao limite de dominância foram classificadas como dominante (D) e as que apresentaram frequência inferior classificadas como não dominante (ND).
Para análise da diversidade foram utilizados os índices de Margalef e Berger-Parker (MAGURRAN, 2011; ARENHARDT, 2016). Para análise da similaridade, foi aplicado o índice quantitativo Bray-Curtis. O cálculo dos índices foi realizado pelo software PAST, versão 3.04 (HAMMER et al. 2001).
Foram coletados exemplares distribuídos em 102 famílias e 17 ordens da Classe Insecta. O maior número de ordens e famílias foram coletados nas áreas de floresta nativa e transposição de galharia. O menor número foi coletado na área de rugosidades no solo (Figura 2). Foram coletados um total de 121.213 artrópodes dos quais 106.216 (87,63%) coletados por armadilhas pitfall e 14.997 (12,37%) a partir das amostras de serapilheira depositadas nos funis de Berlese-Tüllgren. Por área amostral, do total de insetos coletados, 57,22% foram coletados na área com rugosidades no solo, 24,46% na área com transposição de galharia, 12,62% na área com poleiros artificiais e 5,70% na área de floresta nativa (Figura 2).
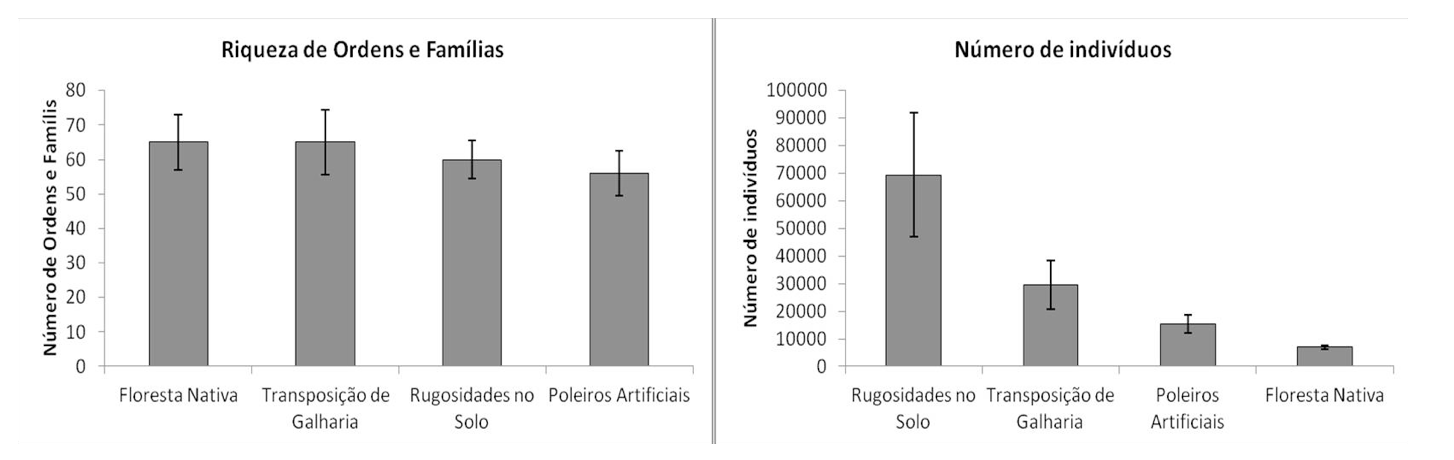
Figura 2. Riqueza de ordens e famílias e número total de indivíduos por área amostral.
Figure 2. Richness from orders/families and total number of individuals per sampled area.
A maior riqueza de ordens e famílias na área de floresta nativa era esperada, uma vez que, esta é a área de referência e se encontra em melhor estágio de conservação e com a maior diversidade de espécies vegetais. A qualidade e a quantidade da serapilheira está diretamente relacionada com a diversidade da cobertura vegetal (MOREIRA et al. 2013). Na área de transposição de galharia, a maior riqueza de ordens e famílias pode ter sido em decorrência da heterogeneidade ambiental na área, com a presença de áreas secas e úmidas, que criou condições para ocorrência de grupos adaptados para cada condição.
Dos artrópodes coletados a partir das armadilhas pitfall, a área de floresta nativa apresentou maior número de grupos classificados como dominantes (D), sendo eles: Classe Collembola (39,38%), família Ptiliidae (Coleoptera) (14,35%), Ordem Diptera (12,51%), família Curculionidae (Coleoptera) (9,36%), família Formicidae (Hymenoptera) (6,84%) família Staphylinidae (Coleoptera) (5,18%) e família Gryllidae (Orthoptera) (3,06%). Na área de transposição de galharia, os grupos classificados como dominantes foram Classe Collembola (92,02%), Ordem Diptera (2,51%) e família Formicidae (Hymenoptera) (2,38%). Na área de poleiros artificiais, os grupos dominantes foram Classe Collembola (77,60%), Ordem Diptera (10,78%) e família Formicidae (Hymenoptera) (4,68%). Na área com rugosidades no solo apenas a Classe Collembola foi dominante (97,60%) (Anexo).
A partir das amostras depositadas nos funis de Berlese-Tüllgren, nas áreas de floresta nativa e poleiros artificiais, os grupos dominantes (D) foram as famílias Formicidae (Hymenoptera) (74,91%), Staphylinidae (Coleoptera) (7,66%) e a Classe Collembola (4,51%). Na área com transposição de galharia, os grupos dominantes foram a Classe Collembola (39,18%), família Formicidae (Hymenoptera) (22,98%), família Staphylinidae (Coleoptera) (12,00%), Ordem Diptera (6,50%), larvas de Coleoptera (6,18%) e ninfas de Hemiptera (2,18%). Na área com poleiros artificiais, a família Formicidae (Hymenoptera) (82,97%), a Classe Collembola (5,08%) e a família Staphylinidae (Coleoptera) (2,92%) foram classificadas como dominantes. Na área de rugosidades no solo, os grupos dominantes foram a família Formicidae (Hymenoptera) (36,12%), Classe Collembola (28,38%), Ordem Diptera (8,46%), a família Staphylinidae (Coleoptera) (6,40%), larvas de Coleoptera (3,87%), e família Aphididae (Hemiptera) (3,14%).
A dominância da família Formicidae era esperada uma vez que este grupo apresenta hábitos sociais (RAFAEL et al. 2012) e constitui um grupo dominante na maioria dos ecossistemas, estando presente nos mais diferentes habitats, desde áreas bem conservadas, até em áreas com algum tipo de degradação e com diferentes tipos de uso do solo (WINK et al. 2005).
A Classe Collembola apresentou elevados valores de frequência relativa em todas as áreas amostrais, sendo classificada como dominante em todas as áreas amostrais nos dados coletados com armadilhas pitfall e funis de Berlese-Tüllgren. A elevada abundância desse grupo é esperada uma vez que os colêmbolos são considerados o segundo grupo mais abundante da mesofauna edáfica e habita, na sua maioria, no sistema solo-serapilheira, onde cumpre funções importantes na ciclagem de nutrientes (MORAIS et al. 2013). São sensíveis às alterações antrópicas, apresentando variações na diversidade e riqueza de famílias, o que possibilita sua aplicação como bioindicadores da qualidade do solo bem como para a detecção de distúrbios (BARETTA et al. 2008).
A família Ptiliidae (Coleoptera) foi classificada como dominante apenas na área de floresta nativa, com frequência relativa de 14,35%, considerando dados das armadilhas pitfall. Nas demais áreas amostrais, a frequência relativa dessa família variou entre 0,156% e 0,033%, indicando que a mesma é sensível às variações que ocorrem no ambiente, ou seja, sua baixa frequência está relacionada à simplificação do ambiente, formado nas áreas sob restauração basicamente pela família Poaceae e apresentando potencial de utilização como bioindicador (WINK et al. 2005) da qualidade do ambiente e do monitoramento de técnicas de restauração de áreas degradadas. A sensibilidade dessa família às alterações no ambiente foi também observada por Marinoni e Ganho (2003). Os insetos dessa família são fungívoros e a cobertura vegetal é um dos fatores que pode afetar a comunidade de fungos do solo (PFENNING, 2013). A área de floreta nativa apresenta maior diversidade de espécies vegetais, criando condições para a formação de uma serapilheira mais diversificada, podendo proporcionar a ocorrência de diferentes microrganismos (PFENNING, 2013). Nas áreas onde encontram-se instaladas as técnicas de nucleação, a formação de serapilheira é praticamente ausente, devido a predominância de pastagem.
A família Curculionidae (Coleoptera) foi representada em sua grande maioria, 97,30% por indivíduos da subfamília Scolytinae, com maior abundância na área de floresta nativa, indicando a preferência desses organismos por ambientes mais bem estruturados do ponto de vista vegetacional, principalmente pela presença de espécies lenhosas. Os organismos dessa subfamília são divididos em dois grupos, de acordo com seu hábito alimentar, sendo: besouros-ambrósia (alimentam-se de fungos simbióticos e vivem no interior de tronco de árvores) e besouros de casca (vivem entre a casca e o lenho, podendo alimentar-se de xilema, floema, medula ou brotos) (FLECHTMANN et al. 1995). Outro aspecto que pode ter influenciado a abundância desses indivíduos, foi em consequência da ocorrência de neve na região de coleta, observada em julho de 2013, evento climático atípico na região, mas que ocasionou a quebra de copas, galhos e ramos de inúmeras árvores disponibilizando material lenhoso à serapilheira. Alguns gêneros dessa subfamília utilizam como hospedeiros árvores recentemente quebradas (WOOD, 1987).
Os índices de diversidade de Margalef e Berger-Parker foram os que melhor caracterizaram a artropodofauna de serapilheira na área de estudo (ARENHARDT, 2016) indicando a área de floresta nativa como a mais diversa (Tabela 1). As áreas que apresentaram menor diversidade foram rugosidades no solo e transposição de galharia.
Índice de diversidade |
Floresta Nativa |
Poleiros Artificiais |
Transposição de Galharia |
Rugosidades no Solo |
Margalef |
6,22 |
5,39 |
5,19 |
4,05 |
Berger-Parker |
0,48 |
0,82 |
0,95 |
0,92 |
Tabela 1. Índices de diversidade de Margalef e Berger-Parker.
Table 1. Margalef and Berger-Parker diversity index.
As florestas conservadas ou que estão em estágio avançado de sucessão apresentam dossel fechado, com tendência de maior deposição de serapilheira (CORREIA et al. 2016). Além disso, a maior diversidade vegetal presente nessas áreas fornece material mais diversificado para a serapilheira, possibilitando o estabelecimento de diferentes famílias, refletindo assim a maior diversidade observada nesta área. Os menores valores observados nas áreas com as técnicas nucleadoras, notadamente nas áreas de transposição de galharia e rugosidades no solo, são em decorrência da simplificação da cobertura vegetal, que no período amostral era formada principalmente por pastagem. A s áreas com as técnicas de poleiros artificiais apresentavam além da pastagem, a presença de indivíduos regenerantes arbustivos e arbóreos, entre eles Ficus luschnathiana (Miq.) Miq. (Moraceae), Miconia tristis Spring (Melastomataceae), Myrsine coriacea (Sw.) R.Br. ex Roem. & Schult. (Primulaceae), Ocotea puberula (Rich.) Nees (Lauraceae) e Sapium glandulosum (L.) Morong (Euphorbiaceae) trazidas pela avifauna.
Pelo índice de similaridade de Bray-Curtis, as áreas mais similares foram a de transposição de galharia e rugosidades no solo (57%) (Figura 3), as mesmas áreas que apresentaram os menores valores de diversidade (Tabela 1). A similaridade da área de floresta nativa e poleiros artificiais foi de 51%.
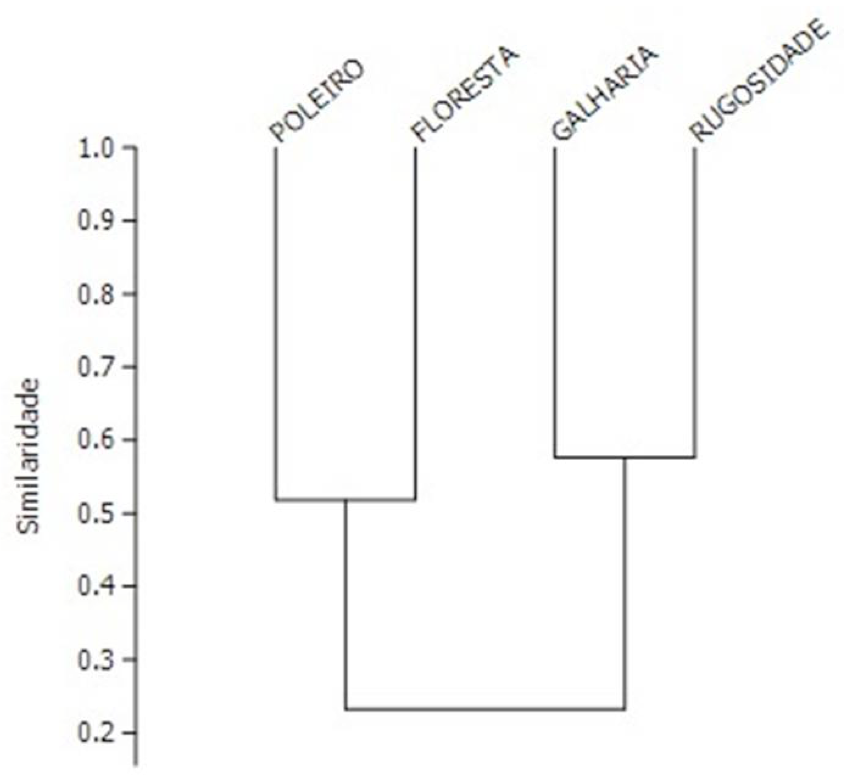
Figura 3. Índice de similaridade de Bray-Curtis.
Figure 3. Bray-Curtis similarity index.
A menor similaridade da área de poleiros artificiais em relação às outras áreas com técnicas nucleadoras pode ser em decorrência da presença de indivíduos herbáceos, arbustivos e arbóreos, apesar de mais similar à área de floresta nativa em relação às demais áreas, o valor de similaridade foi baixo (Figura 3), porém a maior frequência relativa da família Ptiliidae nesta técnica demonstra que a instalação de um processo sucessional favorece a presença deste táxon. As áreas de transposição de galharia e rugosidades no solo foram mais similares por estarem próximas geograficamente e pela presença de mata ciliar e de um fragmento florestal.
A análise dos artrópodes de serapilheira permitiu comparações entre área de floresta nativa e áreas com diferentes técnicas de restauração (nucleação) a fim de verificar as mudanças que ocorrem ao longo do tempo.
A cobertura vegetal é um dos fatores que pode influenciar na composição, riqueza e abundância dos artrópodes de serapilheira.
As famílias Ptiliidae (Coleoptera), Curculionidae (subfamília Scolytinae), Gryllidae (Orthoptera) apresentaram potencial de utilização como bioindicadores da qualidade do ambiente devido à abundância dessas famílias nas áreas amostrais de referência.
À equipe do Projeto Restaurar, ao Banco Nacional do Desenvolvimento Econômico e Social (BNDES) – Iniciativa Mata Atlântica, à Fundação de Amparo à Pesquisa e Inovação do Estado de Santa Catarina (FAPESC) e ao Programa de Pós Graduação em Engenharia Florestal da FURB.
Arenhardt, T. C. P. (2016). A influência de técnicas de restauração na composição da entomofauna de serapilheira no Parque Nacional da Serra do Itajaí, SC. (Dissertação de Mestrado). Universidade Regional de Blumenau. Blumenau.
Aumond, J. J. (2003). Teoria dos sistemas: uma nova abordagem para recuperação e restauração ambiental. In: Simpósio Brasileiro de Engenharia Ambiental, (p.43-49). Itajaí. Brasil.
Baretta, D., Ferreira, C. S., Sousa, J. P., & Cardoso, E. J. B. N. (2008) Colêmbolos (Hexapoda: Collembola) como bioindicadores de qualidade no solo em áreas com Araucaria angustifolia. Revista Brasileira de Ciência do Solo, 32, 2693-2699.
Brasil. (2009). Plano de Manejo do Parque Nacional da Serra do Itajaí. Brasília: Ministério do Meio Ambiente.
Correia, G. G. S., Martins, S. V., Neto, A.M., & Silva, K. A. (2016). Estoque de serapilheira em floresta em restauração e em floresta Atlântica de Tabuleiro no sudeste brasileiro. Revista Árvore, 40, 13-20.
Flechtmann, C. A. H., Couto, H. T. Z., Gaspareto, C. L., & Berti Filho, E. (1995). Scolytidae em reflorestamento com pinheiros tropicais. Piracicaba: IPEF.
Hammer, Ø., Harper, D. A. T., & Ryan, P. D. (2001). PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palacontologia Electronica, 4. Disponível em <http:// palaeo-electronica.org/2001_1/past/issue1_01.htm>.
Louzada, J., & Zanetti, R. (2013). Bioindicadores de Impactos Ambientais. In: Moreira, F. M. S., Cares, J. E., Zanetti, R., & Stürmer, S. L. O Ecossistema Solo. Lavras: UFLA.
Lutinski, J. A., & Garcia, F. R. M. (2005). Análise faunística de Formicidae (Hymenoptera: Apocrita) em ecossistema degradado no município de Chapecó, Santa Catarina. Biotemas, 18(2), 73-86.
Magurran, A. E. (2011). Medindo a diversidade biológica. Curitiba: UFPR.
Marinoni, R. C., & Ganho, H. G. (2003). Fauna de Coleoptera no Parque Estadual de Vila Velha Ponta Grossa, Paraná, Brasil. Abundância e riqueza de famílias capturadas através de armadilhas de solo. Revista Brasileira de Zoologia, 20(4), 737-744.
Martins, S. V. (2013). Restauração ecológica de ecossistemas degradados. Viçosa: UFV.
Morais, J. W., Oliveira, F. G. L., Braga, R. F., & Korasaki, V. (2013). Mesofauna. In: Moreira, F. M. S., Cares, J. E., Zanetti, R., & Stürmer, S. L. O Ecossistema Solo. Lavras: UFLA.
Moreira, F. M. S., Cares, J. E., Zanetti, R. B., & Stürmer, S. L. (2013). O ecossistema solo: componentes, relações ecológicas e efeitos na produção vegetal. In: Moreira, F. M. S., Cares, J. E., Zanetti, R., & Stürmer, S. L. O Ecossistema Solo. Lavras: UFLA.
Pfenning, L. H. (2013). Fungos do solo. In: Moreira, F. M. S., Cares, J. E., Zanetti, R., & Stürmer, S. L. O Ecossistema Solo. Lavras: UFLA.
Rafael, J. A., Melo, G. A. R., Carvalho, C. J. B., Casari, S. A., & Constantino, R. (2012). Insetos do Brasil:Diversidade e taxonomia. Ribeirão Preto: Holos.
Reis, A., Bechara, F. C., Espíndola, M. B., Vieira, N. K., & Souza, L. L. (2003). Restauração de áreas degradadas: a nucleação como base para implementar procesos sucessionais. Natureza & Conservação, 1(1), 28-36.
Schäffer, W. B., & Prochnow, M. (2002). A Mata Atlântica e Você: Como preservar, recuperar e se beneficiar da mais ameaçada floresta brasileira. Brasília: APREMAVI..
Sakagami, S. F., & Laroca, S. (1971). Relative abundance, phenology and flower visited of apid bees in eastern Paraná, Southern Brasil (Hymenoptera: Apidae). Koniyu, 39(3), 217-230.
Silveira Neto, S., Nakano, O., Barbin, D., & Vila Nova, N. A. (1976). Manual de ecologia de insetos. São Paulo: Agronômica Ceres.
Tabarelli, M., Aguiar, A. V., Ribeiro, M. C., & Metzger, J. P. (2012). A conversão da floresta atlântica em paisagens antrópicas: lições para a conservação da biodiversidade biológica das florestas tropicais. Interciencia,37(2), 88-92.
Wink, C., Guedes, J. V. C., Fagundes, C. K., & Rovedder, A. P. (2005). Insetos edáficos como indicadores da qualidade ambiental. Revista de Ciências Agroveterinárias,4(1), 60-71.
Wood, S. L. (1982). The bark and ambrosia beetles of north and Central America (Coleoptera: Scolytidae) a taxonomic monograph. Utah: Brigham Young University.
Composição, abundância - A, frequência relativa - F% e limite de dominância -
LD (ND = não dominante e D = dominante) de artrópodes de serapilheira coletados com armadilhas pitfall.
Floresta |
Galharia |
Poleiro |
Rugosidades |
|||||||||
Ordem/Família |
A |
F (%) |
LD |
A |
F (%) |
LD |
A |
F (%) |
LD |
A |
F (%) |
LD |
Blattodea |
6 |
0,113 |
ND |
7 |
0,026 |
ND |
1 |
0,014 |
ND |
1 |
0,001 |
ND |
Anobiidae |
1 |
0,019 |
ND |
1 |
0,014 |
ND |
2 |
0,003 |
ND |
|||
Bentridae |
1 |
0,019 |
ND |
|||||||||
Biphyllidae |
7 |
0,132 |
ND |
|||||||||
Bruchidae |
4 |
0,076 |
ND |
|||||||||
Carabidae |
1 |
0,019 |
ND |
1 |
0,004 |
ND |
1 |
0,014 |
ND |
1 |
0,001 |
ND |
Cerambycidae |
1 |
0,019 |
ND |
|||||||||
Ceratocanthidae |
1 |
0,019 |
ND |
|||||||||
Chrysomelidae |
22 |
0,416 |
ND |
6 |
0,022 |
ND |
2 |
0,028 |
ND |
5 |
0,007 |
ND |
Cicindelidae |
5 |
0,095 |
ND |
|||||||||
Coccinellidae |
2 |
0,003 |
ND |
|||||||||
Cucujidae |
4 |
0,076 |
ND |
1 |
0,014 |
ND |
||||||
Cupedidae |
1 |
0,019 |
ND |
|||||||||
Curculionidae |
495 |
9,357 |
D |
26 |
0,096 |
ND |
7 |
0,099 |
ND |
19 |
0,028 |
ND |
Dermestidae |
1 |
0,019 |
ND |
|||||||||
Elateridae |
13 |
0,246 |
ND |
3 |
0,011 |
ND |
8 |
0,113 |
ND |
6 |
0,009 |
ND |
Geotrupidae |
1 |
0,004 |
ND |
|||||||||
Gyrinidae |
1 |
0,004 |
ND |
|||||||||
Histeridae |
17 |
0,321 |
ND |
1 |
0,004 |
ND |
2 |
0,003 |
ND |
|||
Hydrophilidae |
1 |
0,019 |
ND |
|||||||||
Leiodidae |
19 |
0,359 |
ND |
1 |
0,004 |
ND |
||||||
Mordellidae |
1 |
0,019 |
ND |
|||||||||
Nitidulidae |
27 |
0,51 |
ND |
14 |
0,052 |
ND |
2 |
0,028 |
ND |
13 |
0,019 |
ND |
Passalidae |
1 |
0,001 |
ND |
|||||||||
Phalacridae |
2 |
0,003 |
ND |
|||||||||
Ptiliidae |
759 |
14,348 |
D |
13 |
0,048 |
ND |
11 |
0,156 |
ND |
22 |
0,033 |
ND |
Ptilodactylidae |
1 |
0,019 |
ND |
|||||||||
Scarabaeideae |
14 |
0,265 |
ND |
3 |
0,011 |
ND |
1 |
0,014 |
ND |
|||
Scydmaenidae |
7 |
0,132 |
ND |
8 |
0,029 |
ND |
3 |
0,043 |
ND |
1 |
0,001 |
ND |
Silphidae |
22 |
0,416 |
ND |
2 |
0,007 |
ND |
1 |
0,014 |
ND |
1 |
0,001 |
ND |
Staphylinidae |
274 |
5,18 |
D |
71 |
0,262 |
ND |
56 |
0,794 |
ND |
52 |
0,078 |
ND |
Tenebrionidae |
4 |
0,076 |
ND |
1 |
0,004 |
ND |
2 |
0,003 |
ND |
|||
Forma Jovem |
30 |
0,567 |
ND |
8 |
0,029 |
ND |
19 |
0,27 |
ND |
6 |
0,009 |
ND |
Coleoptera 01 |
1 |
0,019 |
ND |
|||||||||
Coleoptera 02 |
1 |
0,014 |
ND |
|||||||||
Coleoptera 03 |
1 |
0,004 |
ND |
|||||||||
Collembola |
2083 |
39,376 |
D |
24960 |
92,022 |
D |
5470 |
77,6 |
D |
65149 |
97,597 |
D |
Dermaptera |
9 |
0,17 |
ND |
1 |
0,004 |
ND |
3 |
0,043 |
ND |
4 |
0,006 |
ND |
Diptera |
662 |
12,514 |
D |
680 |
2,507 |
D |
330 |
4,682 |
D |
416 |
0,623 |
ND |
Aphididae |
1 |
0,019 |
ND |
50 |
0,184 |
ND |
38 |
0,539 |
ND |
38 |
0,057 |
ND |
Aradidae |
1 |
0,004 |
ND |
1 |
0,001 |
ND |
||||||
Coreidae |
21 |
0,397 |
ND |
1 |
0,014 |
ND |
2 |
0,003 |
ND |
|||
Cydnidae |
4 |
0,076 |
ND |
2 |
0,007 |
ND |
||||||
Fulgoridae |
2 |
0,007 |
ND |
|||||||||
Gelastocoridae |
1 |
0,004 |
ND |
1 |
0,014 |
ND |
||||||
Hydrometridae |
1 |
0,019 |
ND |
1 |
0,004 |
ND |
||||||
Lygaeidae |
1 |
0,001 |
ND |
|||||||||
Miridae |
13 |
0,246 |
ND |
|||||||||
Nabidae |
8 |
0,151 |
ND |
1 |
0,001 |
ND |
||||||
Pentatomidae |
1 |
0,004 |
ND |
1 |
0,001 |
ND |
||||||
Psyllidae |
1 |
0,014 |
ND |
|||||||||
Pyrrhocoridae |
1 |
0,004 |
ND |
1 |
0,014 |
ND |
||||||
Reduviidae |
1 |
0,004 |
ND |
1 |
0,014 |
ND |
1 |
0,001 |
ND |
|||
Tingidae |
2 |
0,028 |
ND |
|||||||||
Forma Jovem |
27 |
0,51 |
ND |
12 |
0,044 |
ND |
23 |
0,326 |
ND |
29 |
0,043 |
ND |
Hemiptera 01 |
2 |
0,038 |
ND |
|||||||||
Hemiptera 02 |
2 |
0,038 |
ND |
|||||||||
Hemiptera 03 |
1 |
0,001 |
ND |
|||||||||
Hemiptera 04 |
28 |
0,529 |
ND |
|||||||||
Cercopidae |
9 |
0,17 |
ND |
230 |
0,848 |
ND |
77 |
1,092 |
ND |
135 |
0,202 |
ND |
Ciccadelidae |
28 |
0,529 |
ND |
182 |
0,671 |
ND |
144 |
2,043 |
ND |
227 |
0,34 |
ND |
Forma Jovem |
11 |
0,208 |
ND |
58 |
0,214 |
ND |
29 |
0,043 |
ND |
|||
Apidae |
1 |
0,004 |
ND |
|||||||||
Cephidae |
1 |
0,019 |
ND |
|||||||||
Chalcidoidea |
60 |
1,134 |
ND |
29 |
0,107 |
ND |
25 |
0,355 |
ND |
63 |
0,094 |
ND |
Formicidae |
362 |
6,843 |
D |
645 |
2,378 |
D |
760 |
10,782 |
D |
440 |
0,659 |
ND |
Hymenoptera |
2 |
0,003 |
ND |
|||||||||
Ichneunomidae |
1 |
0,019 |
ND |
|||||||||
Pompilidae |
1 |
0,001 |
ND |
|||||||||
Sphecidae |
1 |
0,001 |
ND |
|||||||||
Vespidae |
4 |
0,076 |
ND |
1 |
0,004 |
ND |
3 |
0,043 |
ND |
1 |
0,001 |
ND |
Microhymenoptera |
13 |
0,246 |
ND |
6 |
0,022 |
ND |
4 |
0,057 |
ND |
4 |
0,006 |
ND |
Hymenoptera 01 |
1 |
0,001 |
ND |
|||||||||
Isoptera |
1 |
0,019 |
ND |
|||||||||
Lepidoptera |
6 |
0,113 |
ND |
3 |
0,011 |
ND |
3 |
0,043 |
ND |
13 |
0,019 |
ND |
Neuroptera |
1 |
0,004 |
ND |
|||||||||
Acrididae |
10 |
0,189 |
ND |
4 |
0,057 |
ND |
4 |
0,006 |
ND |
|||
Gryllidae |
162 |
3,062 |
D |
64 |
0,236 |
ND |
31 |
0,44 |
ND |
38 |
0,057 |
ND |
Tetrigidae |
2 |
0,038 |
ND |
1 |
0,004 |
ND |
||||||
Tettigoniidae |
1 |
0,014 |
ND |
1 |
0,001 |
ND |
||||||
Forma Jovem |
6 |
0,113 |
ND |
6 |
0,022 |
ND |
5 |
0,007 |
ND |
|||
Psocoptera |
1 |
0,019 |
ND |
1 |
0,004 |
ND |
||||||
Thysanoptera |
12 |
0,227 |
ND |
6 |
0,022 |
ND |
11 |
0,156 |
ND |
5 |
0,007 |
ND |
Trichoptera |
5 |
0,018 |
ND |
|||||||||
Zoraptera |
2 |
0,007 |
ND |
|||||||||
Total |
5290 |
100 |
27124 |
100 |
7049 |
100 |
66753 |
100 |
||||
Composição, abundância - A, frequência relativa - F% e limite de dominância -
LD (ND = não dominante e D = dominante) de artrópodes de serapilheira
extraídos de amostras de serapilheira depositados em funis de Berlese-Tüllgren.
Floresta |
Galharia |
Poleiro |
Rugosidades |
|||||||||
Ordem/Família |
A |
F (%) |
LD |
A |
F (%) |
LD |
A |
F (%) |
LD |
A |
F (%) |
LD |
Blattodea |
2 |
0,08 |
ND |
2 |
0,02 |
ND |
||||||
Anobiidae |
7 |
0,27 |
ND |
|||||||||
Bostrichidae |
1 |
0,04 |
ND |
5 |
0,06 |
ND |
||||||
Carabidae |
13 |
0,52 |
ND |
6 |
0,07 |
ND |
||||||
Chrysomelidae |
1 |
0,06 |
ND |
2 |
0,08 |
ND |
8 |
0,1 |
ND |
1 |
0,04 |
ND |
Coccinellidae |
2 |
0,08 |
ND |
1 |
0,01 |
ND |
||||||
Cucujidae |
4 |
0,16 |
ND |
8 |
0,31 |
ND |
||||||
Cupedidae |
1 |
0,04 |
ND |
|||||||||
Curculionidae |
28 |
1,73 |
ND |
39 |
1,55 |
ND |
57 |
0,69 |
ND |
34 |
1,3 |
ND |
Elateridae |
1 |
0,04 |
ND |
|||||||||
Endomychidae |
1 |
0,04 |
ND |
|||||||||
Geotrupidae |
1 |
0,06 |
ND |
3 |
0,12 |
ND |
1 |
0,01 |
ND |
2 |
0,08 |
ND |
Histeridae |
2 |
0,12 |
ND |
4 |
0,16 |
ND |
||||||
Hydrophilidae |
4 |
0,16 |
ND |
|||||||||
Leiodidae |
2 |
0,08 |
ND |
|||||||||
Lymexylidae |
1 |
0,01 |
ND |
|||||||||
Mordellidae |
1 |
0,04 |
ND |
|||||||||
Nitidulidae |
1 |
0,06 |
ND |
2 |
0,08 |
ND |
17 |
0,21 |
ND |
6 |
0,23 |
ND |
Passalidae |
2 |
0,08 |
ND |
3 |
0,11 |
ND |
||||||
Platypodidae |
2 |
0,08 |
ND |
|||||||||
Ptiliidae |
2 |
0,12 |
ND |
36 |
1,43 |
ND |
10 |
0,12 |
ND |
51 |
1,95 |
ND |
Scarabaeideae |
2 |
0,08 |
ND |
4 |
0,15 |
ND |
||||||
Scydmaenidae |
21 |
1,3 |
ND |
1 |
0,04 |
ND |
11 |
0,13 |
ND |
|||
Silphidae |
1 |
0,04 |
ND |
1 |
0,04 |
ND |
||||||
Staphylinidae |
124 |
7,66 |
D |
303 |
12 |
D |
241 |
2,92 |
D |
167 |
6,4 |
D |
Forma Jovem |
58 |
3,58 |
ND |
156 |
6,18 |
D |
182 |
2,21 |
ND |
101 |
3,87 |
D |
Coleoptera 01 |
9 |
0,11 |
ND |
|||||||||
Coleoptera 02 |
1 |
0,04 |
ND |
|||||||||
Coleoptera 03 |
1 |
0,01 |
ND |
|||||||||
Coleoptera 04 |
2 |
0,08 |
ND |
|||||||||
Coleoptera 05 |
1 |
0,04 |
ND |
|||||||||
Collembola |
73 |
4,51 |
D |
989 |
39,18 |
D |
419 |
5,08 |
D |
741 |
28,38 |
D |
Dermaptera |
4 |
0,25 |
ND |
1 |
0,01 |
ND |
||||||
Diptera |
35 |
2,16 |
ND |
164 |
6,5 |
D |
97 |
1,18 |
ND |
221 |
8,46 |
D |
Embiidina |
1 |
0,01 |
ND |
|||||||||
Anthocoridae |
1 |
0,04 |
ND |
|||||||||
Aphididae |
17 |
0,67 |
ND |
123 |
1,49 |
ND |
82 |
3,14 |
D |
|||
Belastomatidae |
1 |
0,06 |
ND |
1 |
0,04 |
ND |
||||||
Coreidae |
1 |
0,06 |
ND |
15 |
0,59 |
ND |
13 |
0,16 |
ND |
2 |
0,08 |
ND |
Cydnidae |
1 |
0,01 |
ND |
2 |
0,08 |
ND |
||||||
Fulgoridae |
1 |
0,01 |
ND |
|||||||||
Gelastocoridae |
1 |
0,04 |
ND |
4 |
0,05 |
ND |
15 |
0,57 |
ND |
|||
Lygaeidae |
2 |
0,08 |
ND |
|||||||||
Mesoveliidae |
1 |
0,01 |
ND |
|||||||||
Miridae |
1 |
0,06 |
ND |
2 |
0,08 |
ND |
2 |
0,02 |
ND |
|||
Nabidae |
1 |
0,04 |
ND |
|||||||||
Pentatomidae |
4 |
0,25 |
ND |
1 |
0,01 |
ND |
||||||
Psyllidae |
1 |
0,04 |
ND |
|||||||||
Pyrrhocoridae |
4 |
0,16 |
ND |
8 |
0,1 |
ND |
2 |
0,08 |
ND |
|||
Reduviidae |
1 |
0,01 |
ND |
2 |
0,08 |
ND |
||||||
Rhyparochromidae |
1 |
0,04 |
ND |
|||||||||
Forma Jovem |
12 |
0,74 |
ND |
55 |
2,18 |
D |
54 |
0,66 |
ND |
44 |
1,69 |
ND |
Hemiptera 01 |
1 |
0,04 |
ND |
|||||||||
Cercopidae |
6 |
0,37 |
ND |
21 |
0,83 |
ND |
12 |
0,15 |
ND |
24 |
0,92 |
ND |
Ciccadelidae |
17 |
1,05 |
ND |
29 |
1,15 |
ND |
15 |
0,18 |
ND |
53 |
2,03 |
ND |
Forma Jovem |
2 |
0,12 |
ND |
2 |
0,08 |
ND |
15 |
0,18 |
ND |
12 |
0,46 |
ND |
Chalcidoidea |
12 |
0,48 |
ND |
22 |
0,27 |
ND |
21 |
0,8 |
ND |
|||
Formicidae |
1212 |
74,91 |
D |
580 |
22,98 |
D |
6840 |
82,97 |
D |
943 |
36,12 |
D |
Vespidae |
1 |
0,04 |
ND |
1 |
0,04 |
ND |
||||||
Microhymenoptera |
1 |
0,04 |
ND |
1 |
0,04 |
ND |
||||||
Hymenoptera 01 |
2 |
0,02 |
ND |
|||||||||
Hymenoptera 02 |
3 |
0,04 |
ND |
|||||||||
Isoptera |
1 |
0,04 |
ND |
12 |
0,15 |
ND |
||||||
Microlepidoptera |
1 |
0,04 |
ND |
|||||||||
Forma Jovem |
3 |
0,19 |
ND |
2 |
0,08 |
ND |
2 |
0,02 |
ND |
6 |
0,23 |
ND |
Gryllidae |
1 |
0,06 |
ND |
7 |
0,28 |
ND |
11 |
0,13 |
ND |
5 |
0,19 |
ND |
Forma Jovem |
1 |
0,04 |
ND |
|||||||||
Psocoptera |
3 |
0,12 |
ND |
1 |
0,01 |
ND |
||||||
Thysanoptera |
2 |
0,08 |
ND |
16 |
0,19 |
ND |
4 |
0,15 |
ND |
|||
Trichoptera |
7 |
0,43 |
ND |
27 |
1,07 |
ND |
14 |
0,17 |
ND |
35 |
1,34 |
ND |
Ordem 01 |
1 |
0,06 |
ND |
|||||||||
Total |
1618 |
100 |
2524 |
100 |
8244 |
100 |
2611 |
100 |
||||
1. Mestre em Engenharia Florestal. Laboratório de Monitoramento e Proteção Florestal. Universidade Regional de Blumenau.
2. Graduando em Engenharia Florestal. Laboratório de Monitoramento e Proteção Florestal. Universidade Regional de Blumenau.
3. Doutor em Engenharia Florestal. Laboratório de Monitoramento e Proteção Florestal. Universidade Regional de Blumenau.
4. Doutor em Ciências Biológicas (Entomologia). Laboratório de Monitoramento e Proteção Florestal. Universidade Regional de Blumenau. Email: dinizvitorino@gmail.com