

Vol. 38 (Nº 59) Ano 2017. Pág. 26
Karina Vanelli KOGUTA 1; Vanessa ISHIBASHI 2; Giovana Bomfim de ALCANTARA 3; Antonio Rioyei HIGA 4
Recebido: 14/08/2017 • Aprovado: 12/09/2017
RESUMO: O objetivo deste trabalho foi avaliar a influência de fungicidas (Cercobin® Kasumin® e Dithane®) no meio de cultura para controlar a contaminação de Acacia mearnsii. O delineamento foi em blocos casualizados, com quatro repetições e cinco plantas por parcela. A adição de fungicida ao meio de cultura é uma alternativa viável para o estabelecimento in vitro de explantes. O tratamento com Dithane® proporcionou o menor índice de contaminação (7,5%) aos 21 dias. |
ABSTRACT: The objective of this study was to evaluate the effects of fungicides (Cercobin® Kasumin® and Dithane®) in culture medium to control contamination of Acacia mearnsii. A randomized complete block design with four replicates and five plants per plot was adopted. The addition of fungicides in culture medium is an viable alternative for establishment in vitro of explants. The use of Dithane® showed lowest contamination levels (7.5%) at 21 days. |
Acacia mearnsii De Wild., popularmente conhecida como acácia negra é originada do Sudeste da Austrália e teve seus primeiros plantios comerciais realizados no Brasil, a partir de 1928 (Oliveira, 1968, 121 p.). Estima-se que a área plantada atual com espécies do gênero Acacia seja superior a 148.000 ha (ABRAF, 2013). Acácia negra é utilizada principalmente para produção de madeira (energia, carvão, celulose, painéis de madeira etc.) e casca (tanino, adesivos, floculantes etc.).
Como fixadora de nitrogênio, a espécie pode ser utilizada na recuperação de solos de baixa fertilidade e recuperação ambiental (ABRAF, 2013). Dentre sua importância ecológica, a acácia negra é uma ótima espécie na recuperação ambiental, pois é uma pioneira de vida curta, que cobre rapidamente o solo, não apresenta rebrota de cepa, não inibe a sucessão local e enriquece o solo pela elevada deposição de folhedo rico em nitrogênio (Grigoletti et al., 2003).
A micropropagação apresenta-se como uma técnica importante em parceria com o melhoramento genético florestal. A alta taxa de multiplicação de plantas micropropagadas acelera os programas de propagação clonal e possibilita a clonagem de indivíduos de alto valor e de difícil enraizamento por meio de outras técnicas, como a estaquia (Brondani et al., 2009) e fornece um material livre de patógenos (Sartoretto, Saldanha, Corder, 2008). Para espécies em que a propagação por estaquia encontra dificuldades e a polinização controlada resulta em um número insuficiente de sementes para suprir as demandas de um plantio comercial, como é o caso da acácia negra, a clonagem utilizando a micropropagação é de extrema importância.
Grande parte dos trabalhos de micropropagação com Acacia mearnsii ainda se restringem a partir da germinação in vitro, e não de outras fontes de explantes, como segmentos nodais ou meristemas oriundos de material ex vitro, dificultando assim o resgate de genótipos superiores. Um dos fatores mais críticos da micropropagação é a fase de desinfestação dos explantes para o estabelecimento da cultura asséptica in vitro (Brondani et al., 2009). Para o sucesso na micropropagação a principal dificuldade a ser superada para o sucesso do seu estabelecimento in vitro é o fato da espécie apresentar certa recalcitrância ao ser introduzida, não desenvolvendo brotações e raízes.
Uma das principais utilizações da micropropagação de árvores é a possibilidade de rejuvenescimento de material adulto, além de permitir a multiplicação de genótipos superiores. A micropropagação depende de fatores como o genótipo da planta mãe, das concentrações de reguladores vegetais, do tamanho dos explantes, da composição do meio de cultura e das condições ambientais do cultivo e crescimento (George, 2008, 501 p.).
O meio de cultura mais comumente utilizado para micropropagação de plantas é o MS de Murashige e Skoog (1962). Beck e Dunlop (2001) e Disarz e Martins (2009) obtiveram o melhor resultado para acácia negra utilizando o meio MS¾ com dição de 1 g L-1 de carvão ativado. Resultados positivos para o estabelecimento in vitro de acácia negra foram obtidos utilizando solução contendo o fungicida Benlate® e/ou cloreto de mercúrio (Beck, Dunlop, Van Staden, 1998). Porém, o uso de Benlate® não é mais permitido no Brasil e o cloreto de mercúrio resulta em grande porcentagem de necrose dos explantes devido a sua alta toxicidade (Scherwinski-Pereira, 2010; Grattapaglia, Machado, 1998). Devido a isso, atualmente grande parte dos trabalhos de micropropagação com acácia negra, utilizam material oriundo de germinação in vitro (Disarz, Martins-Corder, 2009; Huang, Al-Khayri, Gbur, 1994) e não de outras fontes de explantes, como segmentos nodais ou meristemas a partir de material genético cultivado em viveiro ou de indivíduos adultos em plantios. Porém esse fungicida não tem sido mais recomendado no Brasil, surgindo a necessidade da pesquisa com outros fungicidas para a desinfestação da espécie para introdução in vitro.
O objetivo deste trabalho foi avaliar a eficácia da adição de diferentes fungicidas (Cercobin® Kasumin® e Dithane®) ao meio de cultura como forma de evitar a contaminação.
Os experimentos foram conduzidos com matrizes selecionadas oriundas do minijardim clonal. A fertirrigação do minijardim foi realizada semanalmente com solução nutritiva preparada com produtos comerciais Kristalon® (NPK 18 18 18) (Yara, Brasil) como fonte de macronutrientes e YaraVita Rexolin BRA® (Yara, Brasil) como fonte de micronutrientes. Aproximadamente 48 h antes da coleta do material o minijardim clonal recebeu tratamento com fungicida Cercobin® 700 WP (Tiofanato-Metílico) (Iharabras, Brasil) na concentração de 2 g L-1.
Foram utilizados como explantes segmentos nodais oriundos de cepas do minijardim clonal com tamanho aproximado de 2 cm, contendo uma gema axilar. Após a coleta os explantes foram imersos em solução de Cercobin® 0,2% p/v por 20 minutos e então lavados em água corrente por 10 minutos. Em câmara de fluxo efetuou-se a tríplice lavagem em água destilada estéril. Em seguida, os explantes foram introduzidos em tubos de ensaio de vidro, de 2 cm de diâmetro por 15 cm de altura, com tampa de polietileno, com 10 ml de meio de cultura.
O meio de cultura utilizado nos experimentos foi o MS (Murashige, Skoog, 1962) com sais reduzidos a ¾ com adição de polivinilpirrolidona (PVP) 0,5% p/v e 30 g L-1 de sacarose. Foi adicionado também ao meio de cultura a solução de desinfestantes de acordo com a tabela 01. O pH foi ajustado a 5,8 ± 2, solidificado com 7,5 g L-1 de ágar bacteriológico (Himedia®). A autoclavagem foi realizada a 121°C e com 1,1 Kgf/cm² de pressão por 20 minutos. As culturas foram mantidas em temperatura de 25 ± 2°C, sob lâmpadas fluorescentes de 30W, gerando luminosidade média de 2800 lux e fotoperíodo de 16 horas de luminosidade.
O delineamento utilizado foi em blocos ao acaso (DBC) com seis blocos e oito explantes por parcela. As avaliações foram realizadas aos 7,14 e 21 dias quando avaliou-se a porcentagem de contaminação por fungos e bactérias e a oxidação dos explantes. Para análise estatística foi realizado um teste de normalidade (Shapiro-Wilk), análise de variância (ANOVA, p<0,05 e p<0,01) e as médias foram comparadas pelo teste de Tukey a 5% de probabilidade, utilizando o software estatístico Assistat® versão 7.7, 2017 (Silva, Azevedo, 2016).

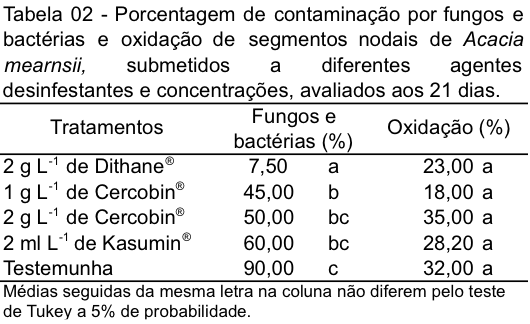
Com a avaliação aos 21 dias o melhor tratamento para desinfestação dos explantes de acácia negra com menor contaminação por fungos e bactérias foi o tratamento com Dithane® (2 g L-1) com apenas 7,5% de contaminação, sendo o único tratamento que diferiu estatisticamente do tratamento testemunha, a qual apresentou a maior porcentagem de contaminação (90%), aos 21 dias. Entre os tratamentos com Cercobin® e Kasumin® não houve diferença estatística. Com relação a variável porcentagem de oxidação dos explantes não houve diferença estatística entre os diferentes agentes desinfestantes testados (Tabela 02).
Em um estudo com o estabelecimento in vitro de segmentos nodais de Psidium guajava L. os tratamentos que incluíram fungicidas no meio de cultura reduziram o aparecimento de fungos no meio de cultivo, o que demonstra que o contato prolongado dos explantes com o fungicida contribuem para o estabelecimento de cultivos assépticos (Ramírez, Salazar, 1997). Entretanto, ainda existem poucos relatos da adição de fungicidas no meio de cultura. A maioria dos trabalhos utilizam os fungicidas antes da inoculação dos explantes em meio de cultivo. Neste sentido, Lafetá et al. (2015), no cultivo in vitro de Eucalyptus grandis x E. urophylla, testaram a imersão dos explantes em diferentes concentrações de Cercobin® (0,5, 1, 2 e 4 g L-1) antes da inoculação dos explantes em meio de cultura e obtiveram contaminação fúngica superior a 25%, entretanto a incidência de fungos foi similar para as diferentes concentrações de fungicida em estudo. Visando o desenvolvimento de um protocolo de desinfestação de Tabebuia rosea Bertol DC para propagação in vitro foi verificado que enxagues prévios com fungicidas e bactericidas juntamente com a desinfestação superficial dos explantes com hipoclorito de sódio não foi suficiente para eliminar completamente os contaminantes, sendo também observado a expressão tardia de contaminações após vários subcultivos (Suárez, Jarma, Avila, 2006).
Salles (2014) estudando a desinfestação superficial de explantes de acácia, utilizou ácido clorídrico, obtendo contaminação de 70% dos explantes e cloreto de mercúrio (HgCl2) a 0,4%, com contaminação de 9%, porém com mortalidade 100% das amostras. Isto mostra que a desinfestação de acácia negra representa ainda um fator limitante ao estabelecimento da cultura in vitro. A maioria dos trabalhos com acacia negra foram realizados com material proveniente da germinação in vitro. No entanto, quando se utiliza material vegetativo proveniente do campo ou casa de vegetação a etapa de inoculação in vitro representa uma etapa crucial ao sucesso do estabelecimento e multiplicação. A adição de fungicidas ao meio de cultura pode ser uma alternativa eficiente para o estabelecimento de acácia negra in vitro. Quando as plantas matrizes utilizadas como fonte de explantes são provenientes do campo os níveis de contaminação tendem a ser maiores. Porém, mesmo as plantas matrizes submetidas a rigoroso controle fitossanitário e mantidas em casa de vegetação são fontes potenciais de contaminação, que podem tornar-se limitantes aos procedimentos de cultivo in vitro (Medeiros, 1999).
A utilização de Dithane® no meio de cultura é uma alternativa a ser considerada quando se deseja evitar contaminações fúngicas no meio de cultura. Entretanto, estudos complementares devem ser conduzidos visando verificar a existência dos efeitos da regeneração in vitro com a aplicação de fungicidas no meio de cultura.
De acordo com os resultados obtidos no presente trabalho conclui-se que a adição de fungicida ao meio de cultura é uma alternativa viável para a introdução in vitro de explantes de A. mearnsii. O fungicida Dithane®, na concentração de 2 g L-1, apresenta-se eficaz para evitar a contaminação de segmentos nodais de A. mearnsii estabelecidos in vitro.
ABRAF - Associação Brasileira de Produtores de Florestas Plantadas (2013). Anuário estatístico da ABRAF 2013 ano base 2012. Recuperado de http://www.ipef.br/estatisticas/relatorios/anuario-abraf13-br.pdf
Beck, S., Dunlop, R., Van Staden, J. (december, 1998). Micropropagation of Acacia mearnsii from ex vitro material. Plant Growth Regulation, 26(3), 143-148.
Beck, S. L., Dunlop, R. W. (September/ October, 2001). Micropropagation of the Acacia species - a review. In Vitro Cellular & Developmental Biology – Plant, 37(5), 531-538.
Brondani, G. E., Dutra, L. F., Grossi, F., Wendling, I., Horning, J. (janeiro/fevereiro, 2009). Estabelecimento, multiplicação e alongamento in vitro de Eucalyptus benthamii Maiden & Cambage x Eucalyptus dunnii Maiden. Revista Árvore, 33(1), 11-19.
Disarz, R., Martins, M. P. C. (2009). Multiplicação de gemas axilares de Acacia mearnsii De Wild. sob diferentes meios de cultura. Revista Árvore, 33(4), 599-606.
George, E. F., Hall, M. H., De Klerk, G. J. (2008). Plant Propagation by Tissue Culture, volume 1. 3 ed. Dordrecht: Springer.
Grattapaglia, D., Machado, M. A. (1998). Micropropagação. In: Torres, A. C., Caldas, L. S., Buso, J. A. Cultura de tecidos e transformação genética de plantas, v. 1.
Grigoletti, A., Santos, A. F., Higa, A. R., Mora, A. L., Simon, A. A., Auer, C., Iede, E. T., Curcio, G. R., Rodigheri, H. R., Dedecek, R. A., Higa, R. C. V., Keil, S. S., Penteado, S. do R. C. (2003).Cultivo da acácia-negra. Colombo: Embrapa Florestas. Recuperado de: http://sistemasdeproducao.cnptia.embrapa.br/FontesHTML/AcaciaNegra/CultivodaAcaciNegra.
Huang, F. H., Al-Khayri, J. M., Gbur, E. E. (january, 1994). Micropropagation of Acacia mearnsii. In Vitro Cellular & Developmental Biology, 30(1), 70-74.
Lafetá, B. O., Penido, T. M. A., Sugawara, M. T. Campos, P. M. de (outubro, 2015). Assepsia de explantes caulinares de eucalipto com fungicida sistêmico. Vozes dos Vales Publicações acadêmicas UFV JM, 8, 1-15.
Medeiros, C. P. C. Indução in vitro de respostas morfogenéticas em explantes nodais de cajazeira (Spondias mombin L.). 1999. 79f. Dissertação (Mestrado) -Universidade Federal do Ceará, Fortaleza.
Murashige, T., Skoog, F. A. (july, 1962). Revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, 15(3), 473-497.
Oliveira, H. A. (1968) (vol. 2). Acácia-negra e tanino no Rio Grande do Sul. Canoas: La Salle.
Ramírez, M., Salazar, E. Establecimiento in vitro de segmentos nodales de guayabo (Psidium guajava L.) (1997). Revista de la Facultad de Agronomía, 14, 497-506.
Salles, E. A. P. B. Micropropagação de Acacia mearnsii De Wild. 2014. 118f. Dissertação (Mestrado) -Universidade Federal do Paraná, Curitiba.
Sartoretto, L. M., Saldanha, C. W., Corder, M. P. M. (maio/junho, 2008). Transformação genética: estratégias e aplicações para o melhoramento genético de espécies florestais. Ciência Rural, 38(3), 861-871.
Scherwinski-Pereira, J. E. Contaminações microbianas na cultura de células e órgãos de plantas. Brasília, DF: Embrapa Informação Tecnológica, 2010, 446p.
Silva, F. de A. S., Azevedo, C. A. V. de, (september, 2016). The Assistat software version 7.7 and its use in the analysis of experimental data. African Journal of Agricultural Research, 11(39), 3733-3740.
Suárez, I. E., Jarma, A. J., Avila, M. (julio/ diciembre, 2006). Desarrollo de un protocolo para propagacion in vitro de roble (Tabebuia rosea Bertol DC). Temas Agrarios, 11(2), 52-62.
1. Aluna de graduação do Curso de Engenharia Florestal, Universidade Federal do Paraná, Curitiba – PR
2. Mestranda do Curso de Pós Graduação em Engenharia Florestal, Universidade Federal do Paraná, Curitiba – PR
3. Professor do Departamento de Ciências Florestais, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR. Email: giobomfim@hotmail.com
4. Professor do Departamento de Ciências Florestais, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR