

Vol. 39 (Nº 13) Año 2018 • Pág. 14
Diego Oswaldo CUMBICOS Ortega 1; Jonathan Alexander RUIZ Carrillo 2
Recibido: 17x/11/2017 • Aprobado: 16/12/2017
RESUMEN: La proliferación de cepas bacterianas de Vibrio spp y Pseudomonas spp son muy perjudiciales en la especie concha prieta (Anadora tuberculosa) puesto que encuentran las condiciones óptimas para su crecimiento, lo que ha generado el interés en conocer la afectación de estos agentes casuales. Un grupo de muestras de la especie, procedente de la captura de los ecosistemas marinos costeras de la Provincia de El Oro, fueron sometidas a pruebas de determinación de Vibrios ssp y Pseudonomas spp, y como resultado se obtuvo un cuadro de vulnerabilidad en cuanto a fuentes de contaminación biológica considerable. |
ABSTRACT: The proliferation of bacterial strains of Vibrio spp and Pseudomonas spp are very damaging in the black seashell species, since they find the optimal conditions for their growth, which has generated the interest in knowing the affectation of these causal agents. A group of samples of the species from the coastal marine ecosystems of the Province El Oro were tested for Vibrios ssp and Pseudonomas spp and, as a result, it was obtained a considerable diagnostic of vulnerability about its biological contamination. |
Los moluscos bivalvos (almejas, mejillones, ostras, conchas, etc), son organismos sedentarios que viven enterrados en el sustrato o sujetos a rocas dentro del agua. Estos animales son considerados micrófagos ya que capturan organismos microscópicos mediante una corriente de agua producida para arrastrarlos hasta su boca. De este modo, la mayoría de ellos filtran el agua e ingieren algas unicelulares, protozoos y partículas orgánicas de variados orígenes. Es por eso que debido a su modo de alimentación los moluscos bivalvos tienden a concentrar ciertos tipos de bacterias, causando enfermedades al organismo y, muchas veces, a la persona que las ingieren (Castillo Rodríguez, 2014; Silva-Benavides & Bonilla, 2015).
Entre estas especies de moluscos bivalvos, destaca la concha prieta (Anadora tuberculosa), considerada una especie en situación vulnerable, debido a su sobre explotación, se torna indispensable conocer cómo identificar las cepas bacterianas del genero Vibrio y Pseudomonas que afectan a sus juveniles (Cáceres-Martínez & Vásquez-Yeomans, 2007; Morán, Severeyn Prof., & Barrios-Garrido Prof., 2014).
En el Ecuador, la recolección de concha prieta se realiza en las zonas provistas de manglares, principalmente en las provincias de Esmeraldas, Guayas y El Oro, siendo esta una de las actividades que genera utilidades a las familias que se dedican a esta faena. En este país se han declarado algunas zonas de protección para la preservación de la mencionada especie. Así también el Ministerio de Agricultura, Ganadería, Acuacultura y Pesca (MAGAP), ha propuesto alternativas de manejo a través de centros de producción de semilla en laboratorio para fines de repoblamiento y sistemas de cultivo acuícolas, estos ensayos han proporcionado datos favorables, generando una sostenibilidad de la especie. Sin embargo se han visto afectados por mortalidades asociadas a infecciones bacterianas a nivel de larvas y de reproductores (E. García Vázquez, A. Hernández Torres, J.A. Herrero Martínez, 2014; Flores, Licandeo, Cubillos, & Mora, 2014).
Con respecto a las enfermedades que afectan a la mencionada especie, la causa principal la constituye la contaminación biológica de las aguas en donde se cultivan. Siendo las bacterias más predominantes: Salmonella spp., Shigella spp., Vibrio parahaemolyticus, Vibrio vulnificus, Vibrio cholerae, Campylobacter spp., Listeria monocytogenes, Escherichia coli. Vibrios spp.; de las que más pueden llegar a afectar el cultivo. Por estas razones se ha visto la necesidad de identificar cepas bacterianas del género Vibrio spp y Pseudomonas spp presentes en juveniles de la especie Anadara tuberculosa, con el fin de conocer la convivencia entre los agentes causales y este bivalvo. En esta investigación se requiere determinar la presencia de Vibrios sppp y Psedumonas spp, a fin de conocer la afectación de estos agentes causales en la especie (Lucero, Cantera, & Nelra, 2012; Muñetón-Gómez, Villalejo-Fuerte, & Gárate-Lizarraga, 2010).
Uno de los sistemas más importantes para la identificación de microorganismos es observar su crecimiento en sustancias alimenticias artificiales preparadas en laboratorio, proporcionando a las bacterias un medio nutritivo que les permita un crecimiento adecuado, además de condiciones adecuadas en cuanto a: temperatura, grado de humedad y presión de oxígeno, así como un grado correcto de acidez o alcalinidad, exento de todo microorganismo contaminante. Entre estos medios se destacan Agar Tiosulfato Citrato Bilis Sacarosa (TCBS) y Agar Cetrimide (Medina, 2012; Miranda, Voltolina, Fierro, López, & Sandoval, 2009)
El Agar TCBS es un medio selectivo para el aislamiento y cultivo de Vibrio cholerae, Vibrio parahemolyticus y otras especies de Vibrio a partir de heces, agua y alimentos contaminados. También es conocido como Agar Tiosulfato Citrato Bilis Sacarosa, o como Agar Selectivo para Vibrios. Es este, el medio selectivo más adecuado para el aislamiento de las especies de Vibrio, e inhibidor para la mayoría de las enterobacterias, debido a las altas concentraciones de tiosulfato y citrato, la presencia de bilis y un pH fuertemente alcalino. La degradación de la sacarosa es variable entre las especies de Vibrio, las colonias son verdes para las cepas que no la utilizan, y amarillas para aquellas que producen ácido a partir de este azúcar. Se recomienda incubar durante 18 a 24 horas con temperatura de 35 a 37 °C (Huff et al., 2012; Rojas, Muñoz, Gárate, González, & Del, 2013).
El Agar Cetrimide es un medio de cultivo selectivo para el aislamiento de Pseudomonas aeruginosa. Inhibe el crecimiento de las bacterias debido a su acción como un compuesto cuaternario de amonio. La base de Agar Cetrimide promueve la producción de piocianina y fluoresceina que se observan con luz ultravioleta en estos cultivos, lo que puede considerarse como prueba presuntiva para su identificación. Luego puede hacerse la prueba oxidasa. Sembrar la muestra de ensayo en la superficie del medio de cultivo por estría cruzada. Se recomienda incubar de 24 a 48 horas a 35 °C (Medina, 2012; Ortega, Santambrosio, & Garibaldi, 2009).
(Muñoz, de Marín, Marval, & Martínez, 2012) realizaron la identificación de bacterias del genero Vibrio asociadas a zonas productoras de moluscos bivalvos, en el estado Sucre, Venezuela. Para desarrollar esta investigación obtuvieron un total de 192 muestras de moluscos bivalvos, mejillón: Perna spp; Arca zebra; Tivela mactroides, provenientes de Punta Patilla, Bahía Iglesia, Isla Lobos-Chacopata y Bahía Güiria, estado Sucre. Los estudios de estos bivalvos para el género Vibrios se enfocaron principalmente para determinar si pueden constituir un riesgo a la salud humana. El período de muestreo comprendió 16 meses (abril-diciembre 2006, enero-julio 2007). Mensualmente se colectaron por cada área tres muestras de bivalvos, y los estudios fueron realizados en el laboratorio de Microbiología de Alimentos del Instituto Nacional de Investigaciones Agrícolas (INIA-Sucre/Nueva Esparta). En la detección de las especies de Vibrio presentes se siguieron las pautas señaladas por Kaysner, De Paola, Barbieri y Col (1998), y en resultados se obtuvo lo siguiente: se identificaron siete especies pertenecientes al género Vibrio: V alginolyticus, V parahaemolyticus, V cholerae N° 01, V vulnificus, V mimicus, V metschnikovii y V hollisae; observándose que la mayoría de las cepas correspondieron a V. Alginolyticus (57,4%) seguida de V parahaemolyticus (22,7%), en todas las muestras probadas de las distintas zonas de estudio.
Para la ejecución de este proyecto se utilizaron técnicas de investigación experimental, bibliográfica y documental para obtener la fundamentación conceptual y contextual; de igual forma para la observación directa y medición para recolectar datos. Se establecieron variables a partir de los objetivos específicos, con sus respectivas dimensiones, indicadores (UFC/g) y unidad de medida (Tabla 1). Los materiales de laboratorio necesarios incluyen: incubadora, tubos de ensayo; cajas petri; 1 pipeta de vidrió de 1 mililitro (ml.): gradilla; mechero; asa de platino; matraz Erlenmeyer; mortero; agar TCBS; agar Cetrimide; agua destilada; guantes; mandil; mascarillas y cofia. Entre las soluciones aparece alcohol potable el mismo que sirvió como antiséptico y esterilizante. Y como material biológico se utilizó Anadara tuberculosa o concha prieta.
Tabla 1
Variables, Dimensiones e Indicadores
Variables |
Dimensiones |
Indicadores |
Unidad de Medida |
Identificar las cepas bacterianas de vibrios en Agar TCBS en juveniles de la concha prieta. |
Presencia o ausencia de vibrios. |
Bacterias vibrios |
(UFC/ml) |
Analizar las cepas bacterianas de Pseudomona en Agar Cetrimide en juveniles de la concha prieta. |
Presencia o ausencia de Pseudomona. |
Concentración de Pseudomonas |
(UFC/ml) |
Fuente: Cumbicos D. y Ruiz J., 2017
El actual trabajo de investigación se ejecutó en las instalaciones del Instituto Tecnológico Superior El Oro en la Laboratorio Nº 2 de la carrera de Tecnología en Acuicultura; ubicado en la ciudad de Machala provincia de El Oro, en la circunvalación norte y antigua vía El Limón en las coordenadas 3° 15` 25,70`` latitud sur, 79° 56` 26,43`` longitud oeste. Para la obtención de la concha prieta, en la primera etapa del estudio se realizó la compra de 12 unidades en total, de las cuales 8 procedieron del muelle Niño Alex que se encuentra ubicado en el Estero Huayla y calle General Páez, en la parroquia de Puerto Bolívar, perteneciente al cantón Machala. Y la diferencia se las obtuvo en el mercado sur que se encuentra ubicado entre las calles Junín y Simón Bolívar. Todas estas especies se verificaron que se encuentren en su etapa juvenil.
Se estableció una programación semanal para determinar la incidencia de Vibrios spp. y Pseudomonas spp., en el periodo comprendido entre el 1 de julio y el 22 de julio del 2017. Al no contar con un autoclave o estufa de aire forzado para generar las condiciones recomendadas para la inhibición de las formas bacterianas, se aplicó otra alternativa, en que los materiales fueron llevados en un recipiente con agua, se tapó y se procedió a hervir en una cocina eléctrica portátil por un tiempo de 45 minutos, posteriormente se retiró los materiales y se llevó a un horno Microondas Whirlpool de 0.7 pies y con capacidad para 20 litros, por un tiempo de 15 minutos a fin de someter a calor seco los materiales, entre los materiales sometidos a este proceso fueron lo que se utilizaron en la inoculación (mortero, cajas Petri, tubos de ensayo, Matraz Erlenmeyer). Para finalizar se retiró y se forro con papel aluminio, asegurándose de cubrir toda la superficie de los materiales y se les ubicó cerca del mechero encendido con el fin de evitar contaminación cruzada.
Los agares fueron preparados en el laboratorio de la carrera Tecnología en Acuicultura que se encuentra en las instalaciones del Instituto Tecnológico Superior El Oro. Al no contar con una autoclave para aplicar la instrucción recomendada por el laboratorio fabricante se realizó la preparación de la siguiente manera: Se pesó 2 gr de agar Cetrimide o TCBS, (de acuerdo a la determinación de agentes causales), se colocó en un matraz Erlenmeyer (100ml.), posteriormente se agregó 25 ml. de agua destilada, y se mezcló de forma homogénea. Seguidamente este matraz Erlenmeyer se lo coloca en la cocina eléctrica y se espera hasta que llegue al punto de ebullición, una vez que haya llegado a su punto de ebullición se lo retira inmediatamente y se lo deja enfriar a temperatura ambiente. Luego se procedió a verter el líquido en las placas Petri (10 ml.) asegurando que el líquido quede de manera uniforme. Y por último, se dejó reposar hasta que se solidificó el agar.
Una vez obtenidas las conchas, para la semana 1 se tomaron 4 unidades, se colocaron en un vaso precipitado de 250 ml. y se les cubrió con papel aluminio, y fueron trasladados al laboratorio. Siguiendo igual procedimiento con la toma de la muestra de la segunda y tercera semana. En el laboratorio se procedió a lavar las valvas con abundante agua y un cepillo de cerdas plásticas a fin de eliminar cualquier elemento visible no característico de la concha, posteriormente se procedió a flamearlas con un mechero para asegurar la asepsia de la muestra. Luego se procedió a abrir la concha y a extraer la pulpa. Después se colocó en el mortero y trituró tratando de homogenizar la muestra, se añadió agua destilada y finalmente se procedió a inocular.
La inoculación se realizó en dilución 10-1 en donde se preparó varios tubos de ensayo para la inoculación de Pseudomonas spp. y otros para Vibrios spp. Con el asa de platino previamente esterilizada se realizó la toma de muestra y se procedió a la inoculación en el agar Cetrimide y TCBS por medio de estrías. Luego se invirtió y se identificó la muestra, así mismo siguiendo los protocoles recomendadas se procedió a incubar a una temperatura de 35 °C por 24 horas, transcurrido este tiempo se realizó el conteo de colonias.
Los resultados obtenidos en la investigación, se presentan en tablas según los indicadores previamente diseñadas.
Tabla 2
Incidencia Semanal de Vibrios spp. en Agar TCBS
Semanas |
Concentración UFC/ml |
1 |
400 |
2 |
800 |
3 |
30 |
Fuente: Cumbicos D. y Ruiz J., 2017
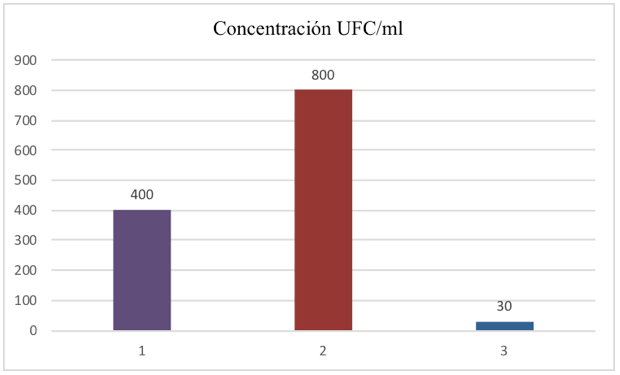
Los datos recopilados en la tabla 2, muestran el mayor crecimiento de Vibrios spp en la semana 2 (800 ufc/ml); mientras que en la semana 1 (400 ufc/ml) que lo ubica en una tasa intermedia con respecto a la semana 2, en la semana 3 (30 ufc/ml), se registró la incidencia bacteriana más baja. Este comportamiento, se explica a través de las distintas fases del ciclo vital bacteriano, tomando en cuenta que solo se preparó una dilución madre, en la primera semana, los microorganismos están en una fase de latencia, reconociendo el medio; por lo que su tasa de crecimiento es lenta; ya en la semana 2, se inicia la fase de crecimiento exponencial y por lo tanto, la proliferación de microorganismos es muy acelerada; lo que explica la duplicación de las formas bacterianas, para luego, a medida que se van agotando los nutrientes y cambiando las condiciones óptimas del medio, disminuye el crecimiento bacteriano, por entrarse a la fase de declive y muerte.
Tabla 3
Incidencia Semanal de Pseudomonas ssp
Semanas |
Concentración UFC/ml |
1 |
Incontables |
2 |
1940 |
3 |
220 |
Fuente: Cumbicos D. y Ruiz J., 2017
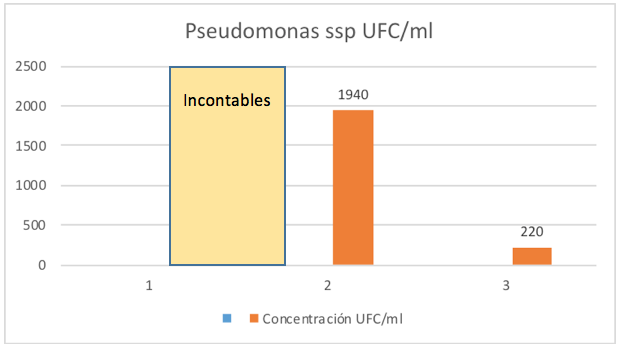
La tabla 3 muestra los valores obtenidos para el crecimiento semanal de Pseudomonas spp, exhibiendo un comportamiento ligeramente diferente al de Vibrio spp (Tabla 2); ya que cada microorganismo tiene sus propias particularidades en su ciclo y la velocidad de crecimiento en esta especie es más rápida que la de Vibrio spp; de allí que reconoce rápidamente el medio de cultivo y por lo tanto, aparece más rápido la fase de latencia, entrando casi de inmediato a la fase exponencial de crecimiento logarítmico (semana 1), empezando a agotar nutrientes y cambiando condiciones del mismo, disminuyendo su crecimiento (semana 2) para continuar su declive en los días siguientes (semana 3). Los resultados de la investigación presentados en las Tablas 2 y 3, son reafirmados por las Gráficas 1 y 2, para una mejor comprensión y visualización de los datos obtenidos durante el proceso de control estadístico.
Grafico 1
Proliferación de Vibrios spp. en UFC/ml
-----
Grafico 2
Proliferación de Pseudomonas spp. en UFC/ml
Se determinó la presencia de cepas bacterianas de Vibrios spp y Pseudomonas spp en la pulpa de la concha prieta (Anadara tuberculosa) en fase juvenil; lo que indica la vulnerabilidad en cuanto a fuentes de contaminación biológica que afectan al cultivo; lo que amerita del diseño e implementación de un programa de manejo.
El conocimiento detallado del ciclo de proliferación bacteriana de Vibrio y Pseudomonas en el cultivo estudiado, servirá de base a futuras investigaciones sobre métodos de control de crecimiento bacteriano que disminuya la mortalidad de la concha prieta en su fase juvenil por ataques microbianos.
Los estudios de estos tipos de cepas bacterianas con potencial patógeno son básicos en el área acuícola, debido a las características del cultivo de moluscos en fases juvenil, y también de adultos. La visión sería hacia la creación de medidas preventivas de infección de los moluscos, limitación del desplazamiento de estos seres en áreas de cultivo, preservar las especies, y fomentar la sostenibilidad de los criaderos. Así, se garantiza la conservación de la biodiversidad y el bienestar de las personas que consumen mariscos.
BENAVIDES, A. L., PRIETO, D. H., MARTINS, J. H., RIBEIRO, G. F., MATIAS, G. de S., LERMEN, F. H., & PIRES, R. L. (2016). Identificación de bacterias potencialmente productoras de aminas biógenas aisladas de queso blanco venezolano. Revista Espacios, 37(36), 21. Retrieved from http://www.revistaespacios.com/a16v37n36/16373621.html
Cáceres-Martínez, J., & Vásquez-Yeomans, R. (2007). La patología en moluscos bivalvos: principales problemas y desafíos para la producción de bivalvos en América Latina. Estado Actual Del Cultivo Y Manejo de Moluscos Bivalvos Y Su Proyección Futura Factores Que Afectan Su Sustentabilidad En América Latina, 12, 327–337.
DOS SANTOS, C. T., MILÉO, F. C., CAMPAGNOLI, E. B., SOUZA PINTO, S. C., ESMERINO, L. A., & LEITE, E. L. (2016). Avaliação da microbiota bucal de pacientes idosos internados em unidade de Terapia Intensiva e Clínica Médica Hospitalar. Revista Espacios, 38(3), 25. Retrieved from http://www.revistaespacios.com/a17v38n03/17380325.html
E. García Vázquez, A. Hernández Torres, J.A. Herrero Martínez, J. G. G. (2014). Cólera y otras infecciones del género Vibrio. Medicine - Programa de Formación Médica Continuada Acreditado, 11(56), 3317–3321. http://doi.org/10.1016/S0304-5412(14)70776-0
Flores, L., Licandeo, R., Cubillos, L. A., & Mora, E. (2014). Intra-specific variability in life-history traits of Anadara tuberculosa (Mollusca : Bivalvia) in the mangrove ecosystem of the Southern coast of Ecuador. Rev. Biol. Trop. (Int. J. Trop. Biol, 62(2), 473–482.
Huff, K., Aroonnual, A., Littlejohn, A. E. F., Rajwa, B., Bae, E., Banada, P. P., … Bhunia, A. K. (2012). Light-scattering sensor for real-time identification of Vibrio parahaemolyticus, Vibrio vulnificus and Vibrio cholerae colonies on solid agar plate. Microbial Biotechnology, 5(5), 607–620. http://doi.org/10.1111/j.1751-7915.2012.00349.x
Lucero, C., Cantera, J., & Nelra, R. (2012). The fisheries and growth of ark clams (arcoida: Arcidae) Anadara tuberculosa in Málaga Bay, Colombian Pacific, 2005-2007. Revista de Biologia Tropical, 60(March), 203–217. Retrieved from http://www.scopus.com/inward/record.url?eid=2-s2.0-84860589811&partnerID=40&md5=0ec2948175745aeedc9ec51afa999e20
Medina, M. (2012). Medios de Cultivo en un Laboratorio de Microbiología. Revista de Investigación, 2(4), 1–42. Retrieved from https://libroslaboratorio.files.wordpress.com/2012/09/medios-de-cultivo-en-un-laboratorio-de-microbiologc3ada.pdf
Miranda, A., Voltolina, D., Fierro, G. I., López, I. O., & Sandoval, I. (2009). Remoción de sólidos suspendidos en los efluentes de una granja camaronera por la almeja pata de mula Anadara tuberculosa (Sowerby, 1833). Hidrobiologica, 19(2), 173–176.
MONTES, R. A., SOUZA, R. O., MORAES, S. R., de MIRANDA, M. G., FRIEDE, R., LIMA, A. L., & AVELAR, K. E. (2017). Qualidade microbiológica de drogas vegetais utilizadas na fitoterapia popular. Revista Espacios, 38(11), 12. Retrieved from http://www.revistaespacios.com/a17v38n11/17381112.html
Morán, L., Severeyn Prof., H., & Barrios-Garrido Prof., H. (2014). Moluscos bivalvos per fora dores de rocas coralinas submareales de la alta guajira, golfo de Venezuela. Interciencia, 39(2), 136–139.
Muñetón-Gómez, M. del S., Villalejo-Fuerte, M., & Gárate-Lizarraga, I. (2010). Gut content analysis of Anadara tuberculosa (Sowerby, 1883) through histological sections. Oceánides, 25(2), 143–148.
Muñoz, D., de Marín, C. G., Marval, H., & Martínez, C. (2012). Identificación de bacterias del género vibrio asociadas a zonas productoras de moluscos Bivalvos, Estado Sucre, Venezuela. Revista Cientifica de La Facultad de Ciencias Veterinarias de La Universidad Del Zulia, 22(5), 459–467.
Ortega, M., Santambrosio, E., & Garibaldi, P. (2009). Preparacion de Medios de Cultivo. Universidad Tecnologica Nacional, 8. Retrieved from http://www.frro.utn.edu.ar/repositorio/catedras/quimica/5_anio/biotecnologia/practicoI.pdf
Rojas, R. N. E., Muñoz, Z. G., Gárate, V. L., González, M. D. V., & Del, P. G. M. F. (2013). Aislamiento microbiologico de Vibrio cholerae y Vibrio parahaemolyticus en muestras de camaron coctelero en la ciudad de Puebla. Enfermedades Infecciosas Y Microbiologia, 33(4), 147–151.
Romalde, J. (2012). Héroes y villanos: bacterias asociadas al cultivo de moluscos. Revista AquaTIC, 37, 45–49. Retrieved from http://www.revistaaquatic.com/aquatic/pdf/37_8.pdf
Silva-Benavides, A. M., & Bonilla, R. (2015). Estructura de la población y distribución de Anadara tuberculosa Sowerby (1833) (Mollusca: Bivalvia) en los manglares de Golfito y Playa Blanca de Puerto Jiménez, Golfo Dulce, Costa Rica. Revista de Biologia Tropical, 63, 287–298. http://doi.org/10.15517/rbt.v63i1.23108
Anexo 1
Cultivo de concha prieta (Anadara tuberculosa)

-----
Anexo 2
Materiales

-----
Anexo 3
Preparación de Agares 1

-----
Anexo 4
Preparación de Agares 2

-----
Anexo 5
Siembra en Agares

-----
Anexo 6
Crecimiento de Vibrios spp. en agar TCBS ( semana 1)
-----
Anexo 7
Crecimiento de Vibrios spp. en agar TCBS (semana 2)
-----
Anexo 8
Crecimiento de Vibrios spp. en agar (semana 3)

-----
Anexo 9
Crecimiento de Pseudomonas spp. en agar Cetrimide (semana 1)

-----
Anexo 10
Crecimiento de Pseudomonas spp. en agar Cetrimide (semana 2)

-----
Anexo 11
Crecimiento de Pseudomonas spp. en agar Cetrimide (Semana 3)
1. Docente del Instituto Tecnológico Superior El Oro. Coordinador de carrera Tecnología en Acuicultura. Ingeniero en Agroalimentaria. Técnico Superior Universitario en Procesamiento y Control de Calidad de Alimentos. ID: orcid.org/0000-0001-6788-0856 correo electrónico: diego_cumbicos@hotmail.com
2. Docente del Instituto Tecnológico Superior El Oro. Departamento de Investigación e Innovación Tecnológica. Doctorando en Ingeniería Industrial. Magíster en Docencia Universitaria e Investigación Educativa. Ingeniero Industrial. ID: orcid.org/0000-0002-9183-0004. Correo electrónico: jruiz@utmachala.edu.ec