

 Vol. 39 (Nº27) Año 2018. Pág. 26
Vol. 39 (Nº27) Año 2018. Pág. 26
Anita RÍOS-Rivera 1; Víctor Julio GARCÍA 2; Roque GARCÍA-Zanabria 3; Carmen Omaira MÁRQUEZ-Pereira 4; Cesar GARCÍA-Ríos 5; Alejandra GARCÍA- Ríos 6
Recibido: 17/02/2018 • Aprobado: 15/04/2018
RESUMEN: Biorreactores con fibra de cabuya mostraron ser más eficaces en la remoción de nitratos y nitritos que los biorreactores con fibra de paja de trigo. La fibra de cabuya como soporte carbonoso de biomasa desnitrificante representa una innovación eficiente y económica para el tratamiento de aguas residuales de pisciculas, facilitando su recirculación y/o reutilización en irrigación agrícola o en vertidos a cuerpos de agua dulce. |
ABSTRACT: Bioreactors with cabuya fiber proved to be more effective in the removal of nitrates and nitrites than bioreactors with wheat straw fiber. Cabuya fiber as a carbonaceous support of denitrifying biomass represents an economic and efficient innovation for the treatment of aquaculture wastewater water, facilitating its recirculation and/or reuse in agricultural irrigation or in discharges to bodies of sweet water. |
El desarrollo de la acuicultura en la región Andina tiene lugar en el contexto de la economía campesina, en unidades a pequeña escala con bajo nivel tecnológico. Uno de los principales retos en el manejo ambiental de estas piscifactorías es el tratamiento y eliminación de aguas residuales con altas cargas de nutrientes –compuestos orgánicos e inorgánicos– que producen eutrofización de los cuerpos de agua receptores (Timmons, Ebeling, & Piedrahita, 2009). La eutrofización origina disminución del oxígeno disponible en aguas profundas debido a la “descomposición” del exceso de materia orgánica. En general estos nutrientes provienen de alimento no consumido y lixiviado (Crab, Avnimelech, Defoirdt, Bossier, & Vestraete, 2007) y de la fertilización orgánica e inorgánica en granjas acuícolas (Tacon & Forster, 2003). Existen varias fuentes importantes de desechos nitrogenados en sistemas de acuicultura: urea, ácido úrico y aminoácido excretado por el pez, restos orgánicos de organismos muertos y moribundos, alimento no consumido y heces y gas nitrógeno de la atmósfera. En particular, los peces expulsan varios productos de desecho nitrogenados a través de las branquias, el intercambio de cationes, la orina y las heces. La remoción de estos compuestos nitrogenados del agua es particularmente importante debido a la toxicidad del amoníaco, el nitrito y, en cierta medida, el nitrato (Ebeling, 2006).
La desnitrificación es el proceso mediante el cual se elimina nitrógeno del agua, es un proceso anaerobio heterotrófico de tipo anóxico. Los procesos más relevantes en la eliminación de nitrógeno del agua incluyen desnitrificacion por intercambio de iones, desnitrificación por reducción desasimilatoria de nitratos y/o nitritos, y desnitrifcación biológica. La desnitrificación biológica se realiza mediante microbios que usan enzimas para degradar nitratos y nitritos y convertilos a nitrógeno molecular (Sirivedhin & Gray, 2006). Las bacterias desnitrificantes más estudiadas incluyen: Paracoccus, Pseudomonas, Thiobacillus, entre otras (Ahn, 2006). Así, se han desarrollado sistemas de desnitrificación biológica basados en bacterias heterotróficas y promovidas para la producción intensiva de camarón marino y tilapia. En estos sistemas, heterotrófico el crecimiento bacteriano se estimula mediante la adición de un sustrato orgánico que contiene carbono (carbonoso). Los valores altos de la relación C/N estimulan la asimilación de amoniaco y nitratos por bacterias heterótrofas directamente del agua eliminando la necesidad de biofiltros fijos externos, así como, la frecuencia de remoción del agua (Ebeling, 2006). El proceso de desnitrificación biológica más habitual se realiza en biorreactores biológicos anóxicos, que emplean soportes en cuya superficie ha crecido una biopelícula (tapiz bacteriano) desnitrificante. El alto costo de soportes sintéticos ha promovido el desarrollo de investigación orientadas a identificar sustratos de origen vegetal que puedan ser más económicos. Así, en un estudio orientado al estudio de soportes de origen vegetal, Saliling, Westerman, & Losordo (2007) mostraron que astillas de madera y la paja de trigo coadyuvan el crecimiento bacteriano de una manera comparable a como lo hacen soportes plásticos en un proceso “KaldnesTM Moving bed” sin embargo este estudio se focalizó en el material del sustrato y no menciona que bacterias desnitrificantes usaron. En un estudio similar, Manoj & Vasudevan (2012) evaluaron la fibra de coco y un reticulado sintético como sustratos y, encontraron que el biorreactor con fibra de coco tuvo un desempeño similar al sustrato sintético. Sin embargo, son pocos los estudios que integran la capacidad de remoción de nitratos y nitritos en un sistema que involucra el uso de fibras naturales como sustrato y biomasa desnitrificante.
En esta investigación se estudió el desempeño de biorreactores que incluyen un sistema de soporte carbonoso constituidos por fibras naturales –cabuya (Furcraea andina) y paja de trigo (Triticum vulgari)– y biomasa desnitrificante –lodo de piscícolas y pseudomonas– en la remoción de nitratos y nitritos en efluentes de pisciculturas. El objetivo fue encontrar un sustrato duradero y económico que permita reducir las dimensiones de los biorreactores mientras que remueve eficiente y efectivamente nitratos y nitritos directamente del agua de efluentes de pisciculturas.
La investigación se realizó en biorreactores anaerobios de flujo ascendente diseñados en concordancia con las especificaciones reportadas por Saliling et al. (2007). Así, se diseñaron a escala de laboratorio un conjunto de 9 biorreactores cilíndricos en correspondencia con el régimen de flujo previsto, el tipo y características de aguas residuales a tratar y las condiciones físicas del medio bacteriano. El volumen total da cada biorreactor fue de 3.5 litros, siendo su volumen útil de 3.1 litros. En los biorreactores se abrieron tres agujeros a diferentes alturas (10, 20 y 30 cm) cada uno con diámetro de 0.00635 m (1/4 pulgada) (Figura 1). En dichos agujeros se adaptaron llaves de paso que permitieron extraer muestras líquidas del efluente a diferentes alturas (profundidades) en el cuerpo interno de los biorreactores.
El sistema funciona por gravedad y en paralelo con una “cabeza” hidráulica de 1 m desde la salida del tanque de carga hasta la entrada de cada biorreactor ubicada en la parte inferior de éste. Con el objeto de regular la presión de salida a diferente nivel de vaciado del tanque de carga se adaptó un dispositivo de “cabeza” constante, con el cuál se logró conseguir un caudal de 15 ml /min y un tiempo de retención hidráulica de 3.8 h. Un tanque de polietileno de 208 litros (55 galones) de capacidad, sirvió como depósito para el almacenamiento de aguas residuales “sintéticas”.
De los 9 biorreactores, 3 se rotularon con las letras “CL” para hacer referencia a sustrato de fibras de cabuya “C” inoculados con lodos “L” de la piscícola. Otros 3 biorreactores, se etiquetaron con las letras “CP” para referirse a sustrato de fibras de cabuya “C” inoculados con pseudomona “P”. Los tres biorreactores restantes se etiquetaron con las letras “TP” en referencia a sustrato de fibra de paja de trigo “T” inoculados con pseudomonas “P”.
Figura 1
Ilustración gráfica del arreglo experimental. El arreglo incluyó 9 biorreactore,
tres medios diferentes, así como la preparación de tres aguas residuales “sintéticas”
con diferentes concentraciones de N-NO3.
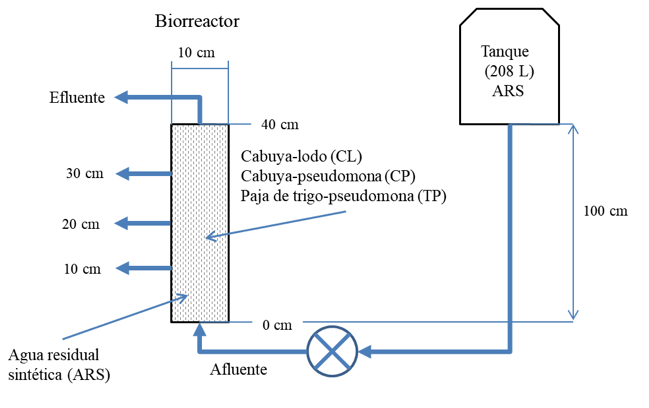
Se prepararon tres formulaciones para obtener ARS con tres diferentes concentraciones de nitratos. EL ARS con una concentración de 10, 50 y 150 mg de N-NO3 /L se denominaron ARS1, ARS2 y ARS3, respectivamente. La composición iónica del agua de estudio, fue similar a la usada por otros investigadores en estudios similares de desnitrificación (Saliling et al., 2007). La composición del agua sintética fue (se expresa la fórmula del compuesto seguida por la concentración en mg/L) para el ARS1 (NaNO3: 60.71 CH3OH: 26.67); ARS2(NaNO3: 303.57 CH3OH: 133.30 ); ARS3(NaNO3: 910.71 CH3OH: 400.05). El resto de componentes del ARS se formularon con las siguientes concentraciones: CaCl2·2 H2O: 82.9; CoCl2·6 H2O: 0.4; KH2PO4: 52.65; MgCl2·2 H2O: 81.96; MnCl2·4H2O: 0.32; (NH4)6Mo7O24·4 H2O: 0.6; ZnSO4·7 H2O: 0.11; NaCl: 56.52; FeSO4·7 H2O: 0.99; Na2SO4: 80; Na2SO3: 40). El Na2SO3 se incorporó para consumir todo el oxígeno disuelto y así asegurar condiciones anóxicas (Gallardo-Rodríguez, Ríos-Rivera, & Felipe-Hernández, 2016). El metanol CH3OH se incorporó en el ARS para que funcione como fuente de carbono y así mejorara el crecimiento de las bacterias (Ahn, 2006; USEPA, 1993). La calidad del ARS para este estudio se verificó a través de un análisis comparativo entre ARS y muestras de aguas de la efluente de una piscícola comercial de producción intensiva de truchas, ubicada en la parroquia Juan de Velazco, localizada al Sur Occidente del Cantón Colta- Ecuador (Gallardo-Rodríguez et al., 2016).
Como sustratos de la biomasa desnitrificante se emplearon fibras de cabuya (Furcraea andina) y paja de trigo (Triticum vulgari) . Antes de ser usadas, las fibras se secaron a 75 oC y se pesaron hasta que se logró medir un peso constante (aprox. después de 24 h). Las fibras de paja de trigo se cortaron en segmentos de 3.5 cm de longitud y se colocaron en los biorreactores TP. La fibra de cabuya se colocó aplicando una ligera presión en forma de zigzag para ocupar el mayor volumen posible dentro de los biorreactores CL y CP.
Una relación C/N baja restringe el proceso de desnitrificación en aguas residuales con baja contenido de carbono orgánico, así que en nuestro estudio agregamos metanol a las ARS en una relación estiquiométrica de 2.27 mg de CH3OH/mg de N-NO3-(Ahn, 2006). El metanol sirve como fuente exógena de carbono y donador de electrones para el desarrollo de la desnitrificación por bacterias heterótrofas, capaces de trabajar en ambiente anóxico.
Al finalizar los ensayos, las fibras que sirvieron de sustrato se lavaron a fondo hasta eliminar la biopelícula. Posteriormente las fibras fueron nuevamente secados y pesados (siguiendo el procedimiento anterior), con el propósito de monitorear la biodegradación de los sutratos.
Cada uno de los 3 biorreactores CL se inoculó con 12 g de lodo proveniente de la piscícola y previamente mantenidos a 4 oC en un contenedor oscuro y sellado, luego cada biorreactor se aforó con ARS1. De manera similar, los 3 biorreactores CP y 3 biorreactores TP se inocularon con pseudomonas, éste género de bacterias está bien caracterizado y se ha reportado en diferentes estudios su gran capacidad para adaptarse a diferentes ambientes, degradar los contaminantes y reducir el carbono y el nitrógeno en los procesos de biorremediación (Ahn, 2006; Foglar, Briški, Sipos, & Vuković, 2005). Las Pseudomonas se aislaron de muestras de lodo provenientes de un sistema de trucha-acuicultura andino (Ecuador), mediante diluciones seriadas y cultivo en placas de Petri con agar cetrimida (22470 Sigma-Aldrich) siguiendo el procedimiento recomendado por (Dáz, Gamazo, & Lopez-Goñi, 1995). Posterior al aislamiento, se colocó 1 L del inóculo con pseudomonas en cada biorreactor CP y CT, se aforó cada birreactor con ARS1. Los biofiltros se cerraron herméticamente y se dejaron en reposo por 96 h para permitir el crecimiento, adaptación y fijación de las pseudomonas en la superficie exterior de las fibras. Luego, se activó el suministro de ARS1 a los biorreactores.
En la fase inicial, se suministró ARS1, luego se hizo circular ARS2 y finalmente se suministró ARS3 en un experimento que duro 60 d. Se cambió secuencialmente el suministro de ARS en la afluente (simulando un cambio en la carga de nitratos) una vez que la concentración de nitratos en las efluentes de los biorreactores alcanzó un valor inferior al límite máximo permitido para aguas destinadas al riego agrícola (10 mg/L de N-NO3- y 1 mg/L de N-NO2). En concordancia con el Texto unificado de legislación secundaria del Ministerio del Ambiente 2015 en Ecuador(Ministerio del Ambiente del Ecuador, 2015). En general, cada ARS circuló por los biorreactores durante un ciclo de 20 días. El porcentaje de reducción de N-NO3- (%RN) fue calculada con la ayuda de la ecuación (1).

Para el análisis estadístico de los datos se realizó con la ayuda del software para análisis estadístico suministrado por Minitab Inc. (2009). Se realizó un análisis de variancia (ANOVA) para determinar cuando los valores medios de las mediciones realizadas en los biorreactores CL, CP y TP fueron diferentes. Antes de proceder con el ANOVA se realizaron las pruebas de normalidad y de homogeneidad de la varianza en los datos crudos. Cuando el ANOVA resultó en un valor de “p” menor que un nivel de significancia de 0.05 se concluyó qué los valores medios comparado eran estadísticamente diferentes.
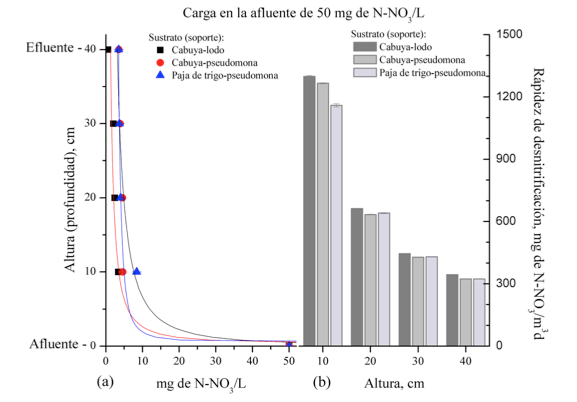
En la Tabla 1, se presentan los valores medios de la concentración de N-NO3 en la afluente y en la efluente, así como, el porcentaje de remoción correspondiente y la rápidez de desnitrificación en condiciones seudo-estacionarias (SE). El estado “SE” se definió como el valor medio de los resultados obtenidos en los tres últimos puntos de medida en cada uno de los ciclos (20 días) de carga de ARS. Cuando circuló el ARS1 (una carga de 10 mg de N-NO3/mg L en la afluente), no se observaron diferencias significativas (p > 0.05) entre los valores medios obtenidos para los biorreactores CL y CP, al igual que entre los biorreactores CL y TP, mientras que, existieron diferencias significativas entre los biorreactores CP y TP (p < 0.05). En este caso, el biorreactor TP mostró el mayor poder de remoción de N-NO3 y de rápidez de desnitrificación.
Cuando circuló el ARS2, con una carga de 50 mg de N-NO3/mg L, no se observaron diferencias significativas (p > 0.05) entre los valores medios obtenidos par los biorreactores CP y TP, mientras que los valores medios obtenidos para el biorreactor CL fueron significativamente diferentes (p < 0.05) de los logrados con los biorreactores CP y TP. En este caso, el biorreactor CL exhibió el mayor poder de remoción de N-NO3 y de rápidez de desnitrificación.
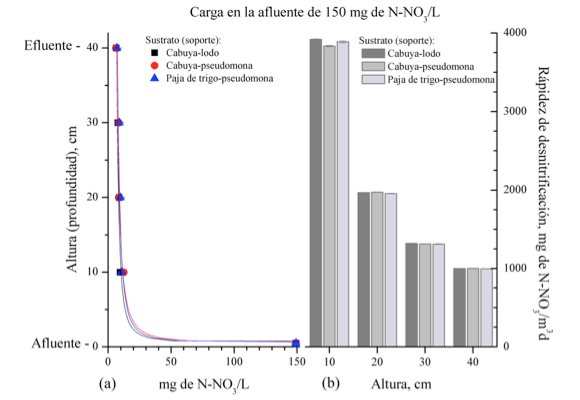
Cuando circuló el ARS3, con una carga de 150 mg de N-NO3/mg L, no se observaron diferencias significativas (p > 0.05) entre los valores medios obtenidos en los biorreactores CL y CP, mientras que los valores medios obtenidos para el biorreactor TP fueron significativamente diferentes (p < 0.05) de los logrados en los biorreactores CL y CP . En este caso, los biorreactores CL y CP exhibieron el mayor poder de reducción N-NO3 y de rápidez de desnitrificación.
Aunque en el primer ciclo de carga (AR1) el biorreactor TP exhibió mayor rapidez de desnitrificación, al final del tercer ciclo de carga (AR3) los biorreactores CL y CP exhibieron mayor rapidez de desnitrificación. Este resultado sugiere que la biomasa desnitrificante se desarrolla más rápido en la superficie de la fibra de trigo que en la superficie de la fibra de cabuya y que en ésta la biomasa desnitrificante se desarrolla con el tiempo. Así, los biorreactores CL y CP logran exhibir un mejor desempeño con el tiempo. La lenta adaptación de las bacterias sobre la fibra de cabuya favorece un mejor desempeño de la fibra de trigo en el primer ciclo. Aunque, los dos sustratos son de naturaleza orgánica, la rugosidad y la inherente disponibilidad de nutrientes en la superficie de la fibra de trigo hacen que su superficie sea más “atractiva” para el crecimiento de la biopelícula.
En condiciones seudo-estacionarias más del 80% de la concentración de N-NO3 son eliminados en todos los biorreactores (Tabla 1). Las tasas de desnitrificación toman valores que van desde aproximadamente 55 a 1002 g N-NO3-/m3d. Los valores obtenidos en el estado seudo-estacionario de biorreactores TP con el ARS2 (carga de 50 mg de N-NO3 /mgL, son similares a los reportados por Saliling et al. (2007) en biorreactores con un sustrato conformado por fibras de paja de trigo y bacterias.
Tabla 1
Valores medios de la concentración de N-NO3 en la afluente y efluente, porcentaje
de reducción y tasa de desnitrificación en los tres tipos de biorreactores en estado
seudo-estacionario. Entre paréntesis, se presenta la desviación estándar. Letras diferentes
significa que hay diferencia significativa entre los valores medios (p < 0.05).
Afluente Carga de N-NO3 (mg/L) |
Tipo de medio (soporte) del biorreactor |
Efluente Concentración N-NO3 (mg/L) |
Porcentaje de reducción (%) |
Rapidez de desnitrificación (g de N-NO3/m3d) |
10
|
CL |
1.72 (0.22) ab |
82.83 (2.18) ab |
57.72 (1.51) ab |
CP |
2.03 (0.15) a |
79.67 (1.53) a |
55.51 (1.06) a |
|
TP |
1.50 (0.15) b |
85.00 (1.45) b |
59.23 (1.01) b |
|
50
|
CL |
0.58 (0.07) a |
98.84 (0.14) a |
344.36 (0.48) a |
CP |
3.56 (0.13) b |
92.89 (0.25) b |
323.61 (0.88) b |
|
TP |
3.49 (0.17) b |
93.02 (0.34) b |
324.08 (1.19) b |
|
150
|
CL |
6.33 (0.17) a |
95.78 (0.11) a |
1001.03 (1.16) a |
CP |
6.19 (0.14) a |
95.87 (0.09) a |
1002.04 (0.94) a |
|
TP |
7.02 (0.30) b |
95.32 (0.20) b |
996.23 (2.09) b |
En la Figuras 2a, 3a y 4a se representa como varía la concentración de N-NO3 con la altura (profundidad) en el biorreactor. La tendencia a la disminución en la concentración de NO3 con la altura (Figura 2a, 3a y 4a) se fue haciendo más similar e independiente del tipo de fibras en la medida que aumento la carga de N-NO3 en la afluente. Este efecto se puede deber a pequeñas diferencias en la consolidación del material bio-desnifricante en los biorreactores, puesto que la mayor carga (150 mg de N-NO3/L) se aplicó una vez que culminado los dos primer ciclos de carga (40 d).
En la Tabla 2, se listan los porcentajes de remoción N-NO3 a diferentes alturas en el biorreactor. En esta tabla, se puede observar que a una altura de 10 cm y cuando la carga en la afluente fue de 10 mg de N-N3/L, el porcentaje de remoción estuvo entre 64 y 72 % en todos los biorreactores. La mayor remoción (71%) la exhibe los biorreactores CL y no existieron diferencias significativas entre los valores medios del porcentaje de remoción entre los biorreactores CR y TP. Mientras que, la remoción fue entre 83 y 94% en los primeros 10 cm cuando la carga fue de 50 mg de N-NO3 /L, la mayor remoción la exhibió el biorreactor CL con un 93%, los valores medios del porcentaje de remoción en los biorreactores CL, CP y TP exhibieron diferencias significativas. De igual manera, en los primeros 10 cm y cuando la carga fue de 150 mg de N-NO3/L la remoción fue entre 90 y 94%, siendo el mayor valor de 94% exhibido por el biorreactor CL, sin embargo, no se manifestaron diferencias significativas entre los biorreactores CL y TP.
Tabla 2
Valores medos del porcentaje de remoción de N-NO3 a diferentes alturas (profundidades)
en el biorreactor. Entre paréntesis, se presenta la desviación estándar.
Letras diferentes significa que hay diferencia significativa entre los valores medios (p < 0.05).
Afluente Carga de N-NO3 (mg/L) |
Sustrato (soporte) del biorreactor |
Porcentaje de remoción a 10 cm (%) |
Porcentaje de remoción a 20 cm (%) |
Porcentaje de remoción a 30 cm (%) |
10
|
CL |
71.22 (1.07) a |
73.56 (1.35) ab |
78.94 (1.95) b |
CP |
64.00 (0.88) b |
71.33 (1.53) b |
75.00 (1.16) c |
|
TP |
64.33 (2.60) b |
75.22 (0.19) a |
83.56 (0.96) a |
|
50
|
CL |
93.22 (0.34) a |
95.16 (0.21) a |
95.87 (0.24) a |
CP |
90.84 (0.21) b |
90.93 (0.29) c |
92.22 (0.27) b |
|
TP |
83.20 (0.70) c |
91.96 (0.44) b |
92.62 (0.34) b |
|
150
|
CL |
93.74 (0.23) a |
94.13 (0.13) a |
94.84 (0.24) a |
CP |
91.72 (0.27) b |
94.39 (0.06) a |
94.34 (0.10) a |
|
TP |
92.96 (0.45) a |
93.58 (0.23) b |
94.16 (0.53) a |
En la Tabla 3, se lista la rápidez de desnitrificación a diferentes alturas en los biorreactores CL, CP y TP. En esta tabla se puede observar la rápidez de desnitrificación varió entre 65 a 3920 g de N-NO3/m3d en todos los biorreactores. Estos valores son similares a los reportados por Saliling et al. (2007) y van Rijn, Tal, & Schreier (2006). Los valores más altos de desnitrificacion se exhibieron en los primeros 10 cm de todos los biorreactores e independiente de la carga de N-NO3 en la afluente (Figura 2b, 3b y 4b). Este resultado sugiere que todos los biorreactores se pueden desempeñar a una rápidez de desnirificación mayor que lo estimado para el biorreactor completo. De manera que, se puede pensar en incrementar la carga de N-NO3 en la afluente manteniendo el tamaño de 40 cm del biorreactor. También, se podría pensar en incrementar el caudal en la afluente, pues el perfil de la concentración de N-NO3 con la altura en el biorreactor sugiere que la rápidez de carga hidráulica limita el valor óptimo de la concentración de N-NO3 en la afluente (Saliling et al., 2007).
La mayor rápidez de desnitrificación la exhibieron los biorreactores CL en los primeros 10 cm e independiente de la carga de N-NO3 en la afluente. Sin embargo, a los 30 cm y cuando la carga en la afluente fue de 150 mg de N-NO3/L no existieron diferencias significativas en la rápidez de desnitrificación en los tres grupos de biorreactores.
Tabla 3
Valores medios de la rápidez de desnitrificación a diferentes alturas en los biorreactores.
Entre paréntesis se presenta la desviación estándar. Letras diferentes significa
que si hay diferencia significativa entre los valores medios (p < 0.05).
Afluente Carga de N-NO3 (mg/L) |
Sustrato (soporte) del biorreactor |
Rápidez de desnitrificación10 cm (g de N-NO3/m3d) |
Rápidez de desnitrificación 20 cm (g de N-NO3) /m3d) |
Rápidez de desnitrificación 30 cm (g de N-NO3) /m3d) |
10
|
CL |
198.50 (2.99) a |
102.50 (1.88) ab |
73.34 (1.81) b |
CP |
178.37 (2.46) b |
99.41 (2.13) b |
69.68 (1.07) c |
|
TP |
179.30 ( 7.26) b |
104.83 (0.27) a |
77.63 (0.89) a |
|
50
|
CL |
1299.10 (4.68) a |
663.20 ( 1.49) a |
445.32 ( 1.12) a |
CP |
1266.00 (2.99) b |
633.60 ( 2.02) c |
428.39 (1.25) b |
|
TP |
1159.43 (9.79) c |
640.72 (3.09) b |
430.25 (1.59) b |
|
150
|
CL |
3918.97 (9.70) a |
1967.69 (2.79) a |
1321.60 (3.34) a |
CP |
3834.43 (11.20) b |
1972.96 (1.17) a |
1314.37 (1.40) a |
|
TP |
3886.45 (18.80) a |
1956.08 (4.71) b |
1312.10 (7.44) a |
Figura 2
(a) Valor medio de la concentración de N-NO3- (mg/L) y (b) Valor medio de la
rápidez de desnitrificación en los biorreactores CL, CP, TP a diferentes alturas en el
biorreactor. La carga en la afluente fue de 10 mg de N-NO3-/L (ARS1).
El valor a una altura de 0 cm corresponde con la concentración del afluente
y el valor a 40 cm corresponde con la concentración en la efluente.
-----
Figura 3
(a) Valor medio de la concentración de N-NO3- (mg/L) y (b) Valor medio de la
rápidez de desnitrificación en los biorreactores CL, CP, TP a diferentes alturas en el
biorreactor. La carga en la afluente fue de 50 mg de N-NO3-/L (ARS2).
El valor a una altura de 0 cm corresponde con la concentración del afluente
y el valor a 40 cm corresponde con la concentración en la efluente

-----
Figura 4
(a) Valor medio de la concentración de N-NO3- (mg/L) y (b) Valor medio de la
rápidez de desnitrificación en los biorreactores CL, CP, TP a diferentes alturas en
el biorreactor. La carga en la afluente fue de 150 mg de N-NO3-/L (ARS3).
El valor a una altura de 0 cm corresponde con la concentración del afluente
y el valor a 40 cm corresponde con la concentración en la efluente.
En la Figura 4 se representa gráficamente el promedio total (PT) de los valores de concentración de nitritos (mg de N-NO2/L) en muestras de agua tomadas a diferentes alturas en el biorreactor. El valor PT resultó de promediar los valores medidos registrados todos los días durante los tres ciclos de trabajo del biorreactor (60 d). También, se representa en la Figura 4, el promedio “SE” de los valor de la concentración de nitritos (mg de N-NO2/L) medidos en el estado seudo-estacionario de los tres ciclos de trabajo (de 20 d c/u). Se puede apreciar en la Figura 4, que los biorreactores CL con una altura mínima de 30 cm descargarían a la efluente aguas con una concentración de nitritos inferior al límite máximo permitido por la legislación ecuatoriana, cuando la concentración de N-NO3 en la afluente varía entre 10 a 150 mg de NO3+N-NO2/L. Mientras que, en los biorreactores CP la altura mínima necesaria para que se descarguen nitritos en concentraciones menores de 1 mg/L es de 40 cm. Sin embargo, en los biorreactores TP, nuestros resultados sugieren que la altura mínima necesaria para descargar agua con una concentración de nitritos inferior al límite permitido debe ser mayor a 40 cm. Así, podemos concluir que el biorreactor TP, requiere mayor altura (profundidad) para que la concentración de nitrito se reduzca a los valores permitidos en la legislación Ecuatoriana (N-NO2- < 1mg/L). En la Figura 4, se puede apreciar que si mantenemos la altura en 40 cm, la capacidad de remoción de nitritos en los biorreactores varia de mayor a menor en el siguiente orden CL > CP > TP.
La fibra de cabuya después del proceso de desnitrificación durante un tiempo de 60 días, perdió 19,90% de su masa inicial, mientras que la masa de la paja del trigo fue reducida al 51,86%. Analizando los porcentajes de reducción de masa, las fibras de la cabuya se degradarían aproximadamente el 50% en un año o alrededor de 1.39 g de perdida por kg de masa inicial por día. Por otro lado, la fibra de paja de trigo se degradaría más del 98% en un año o 2.68 g perdidos por kg de masa inicial por día. Este resultado sugiere que la fibra de paja de trigo contiene carbono orgánico más accesible y por lo tanto fácilmente digerible por la biomasa desnitrificante. De manera que, la fibra de paja de trigo se comportar como una fuente exógena de carbono que coadyuva a la bio-desnitrificación y se biodegrada “rápidamente”. Por consiguiente, es de esperar que el biorreactor TP pueda tener un buen desempeño con menor cantidad de metanol, pues la fibra de paja de trigo funciona como una fuente alternativa de carbono exógeno para la bio-desnitrificación. Mientras que, el carbono orgánico en la fibra de cabuya esta menos accesible a la biomasa desnitrificante y se biodegrada lentamente. Así, los biorreactores con fibra de cabuya requieren mayor cantidad de carbono exógeno que coadyuve a la bio-desnitrificación.
Figure 5. Valores de la concentración N-NO2 en muestras de agua tomadas a diferentes alturas en el biorreactor. Se muestran los valores promedio totales (PT) obtenidos durante los tres ciclos de funcionamiento de los bioreractores. También se muestran los valores promedios obtenidos en el estado seudo-estacionario (SE). La línea horizontal resalta el límite superior en la concentración de nitritos permitida por la legislación ecuatoriana (N-NO2-< 1mg/L).
La biomasa desnitrificante se desarrolla más rápido en la superficie de la fibra de trigo que en la de la fibra de cabuya. Así, el biorreactor TP exhibió un desempeño ligeramente superior (porcentaje de remoción de 85%) y significativamente diferente al inicio del ensayo, que el mostrado por el biorreactor CP (porcentaje de remoción de 79%). Sin embargo, al final del ensayo, los biorreactores CL, CP y TP mostraron un desempeño similar (porcentaje de remoción mayor al 95%), siendo el desempeño de los biorreactores CL y CP significativamente diferentes y ligeramente mejor que el desempeño del biorreactor TP.
Los biorreactores CL y CP mostraron mayor eficacia removiendo nitritos que el biorreactor TP. El biorreactor CL mostró ser el más eficaz reduciendo las concentraciones de nitritos a valore muy inferiores a lo establecido en la legislación ecuatoriana. La capacidad de remoción de nitritos varió de mayor a menor en el siguiente orden CL > CP > TP.
Los biorreactores CL y CP con dimensiones de 40 cm mostraron ser más eficaces en la remoción de nitratos y nitritos que los biorreactores TP con similares dimensiones. Así, los biorreactores CL y CP cumplen con la normativa ambiental ecuatoriana en lo referido a criterios de calidad de aguas para riego agrícola o en vertidos a cuerpos de agua dulce.
Nuestros resultados sugieren que en aplicaciones de bio-desnitrificación, la fibra cabuya ofrece mayor durabilidad, pues se estima que en un año se puede degradar el 50%, mientras que la fibra de paja de trigo se degradaría un 98%. Así, la fibra de cabuya como soporte de biomasa desnitrificante representa una alternativa eficiente, simple y económica para el tratamiento de aguas residuales de acuicultura, de manera que los efluentes de esta industria se pueden reutilizar en proyectos de irrigación agrícola o en vertidos a cuerpos de agua dulce.
Ahn, Y. H. (2006). Sustainable nitrogen elimination biotechnologies: A review. Process Biochemistry, 41(8), 1709–1721. https://doi.org/10.1016/j.procbio.2006.03.033
APHA. (2005). Standard Methods for the Examination of Water and Waste water (21st ed.). Washington D.C.: American Public Health Association.
Chan, Y. J., Chong, M. F., Law, C. L., & Hassell, D. G. (2009). A review on anaerobic-aerobic treatment of industrial and municipal wastewater. Chemical Engineering Journal, 155(1–2), 1–18. https://doi.org/10.1016/j.cej.2009.06.041
Crab, R., Avnimelech, Y., Defoirdt, T., Bossier, P., & Vestraete, W. (2007). Nitrogen removal techniques in aquaculture for a sustainable production. Aquaculture, 270, 1–14.
Dáz, R., Gamazo, C., & Lopez-Goñi, I. (1995). Manual práctico de Microbiología. Allergologia et Immunopathologia, 23, 47.
Ebeling, J. M. (2006). Biofiltration ‐ Nitrification Design Overview. New Orleans. LA.
Foglar, L., Briški, F., Sipos, L., & Vuković, M. (2005). High nitrate removal from synthetic wastewater with the mixed bacterial culture. Bioresource Technology, 96, 879–888. https://doi.org/10.1016/j.biortech.2004.09.001
Gallardo-Rodríguez, J. J., Ríos-Rivera, A., & Felipe-Hernández, D. (2016). Evaluation of Furcraea Andina Fibers as Bacterial Support for Biological Denitrification. Journal of Natural Fibers, 13(6), 691–701. https://doi.org/10.1080/15440478.2015.1130004
Manoj, V. R., & Vasudevan, N. (2012). Removal of nutrients in denitrification system using coconut coir fibre for the biological treatment of aquaculture wastewater. Journal of Environmental Biology, 33(2), 271–276.
Ministerio del Ambiente del Ecuador. (2015). Texto unificado de Legislación Secundaria del Ministerio del Ambiente. Libro VI, Anexo I: Norma de calidad ambiental y de descarga de efluentes: rescurso agua. https://doi.org/10.1017/CBO9781107415324.004
Minitab Inc. (2009). Minitab Statistical Software. State College Pennsylvania USA. Retrieved from www.minitab.com
Saliling, W. J. B., Westerman, P. W., & Losordo, T. M. (2007). Wood chips and wheat straw as alternative biofilter media for denitrification reactors treating aquaculture and other wastewaters with high nitrate concentrations. Aquacultural Engineering, 37(3), 222–233. https://doi.org/10.1016/j.aquaeng.2007.06.003
Sirivedhin, T., & Gray, K. A. (2006). Factors affecting denitrification rates in experimental wetlands: Field and laboratory studies. Ecological Engineering, 26(2), 167–181. https://doi.org/10.1016/j.ecoleng.2005.09.001
Tacon, A. G. J., & Forster, I. P. (2003). Aquafeeds and the environment: Policy implications. Aquaculture, 226(1–4), 181–189. https://doi.org/10.1016/S0044-8486(03)00476-9
Timmons, M. B., Ebeling, J. M., & Piedrahita, R. H. (2009). Acuicultura en Sistemas de Recirculacion. Ithaca, NY: Cayuga Aqua Ventures, LLC.
USEPA. (1993). Standards for the use or disposal of sewage sludge; final rules. 40 CFR Part 503 Subpart D. Fed. Regist. 58:9398-9400.
van Rijn, J., Tal, Y., & Schreier, H. J. (2006). Denitrification in recirculating systems: Theory and applications. Aquacultural Engineering, 34(3), 364–376. https://doi.org/10.1016/j.aquaeng.2005.04.004
Warneke, S., Schipper, L. A., Bruesewitz, D. A., & Baisden, W. T. (2011). A comparison of different approaches for measuring denitrification rates in a nitrate removing bioreactor. Water Research, 45(14), 4141–4151. https://doi.org/10.1016/j.watres.2011.05.027
1. PhD en Ciencias Ambientales. Universidad Nacional de Chimborazo. arios@unach.edu.ec
2. PhD en Ciencias e Ingeniería de Materiales, Universidad Nacional de Chimborazo. vgarcia@unach.edu
3. PhD en Ciencias Ambientales. Escuela Superior Politécnica de Chimborazo. rogarcia@espoch.edu.ec
4. PhD en Forest Biology. Universidad Nacional e Chimborazo. cmarquez@unach.edu.ec
5. MSc en Seguridad Industrial y Salud Ocupacional. cesargarcia30@gmail.com
6. MSc en Seguridad Industrial y Salud Ocupacional. Cecygar20@hotmail.com