

Vol. 39 (Nº 39) Ano 2018 • Página 16
Darley Calderaro Leal MATOS 1; Leandro Valle FERREIRA 2; Marcos Bergmann CARLUCCI 3
Recebido: 07/04/2018 • Aprovado: 19/05/2018
RESUMO: Este estudo testou se diferentes estratégias funcionais são formadas entre indivíduos de Macrolobium angustifolium (Benth.) R.S.Cowan, espécie arbórea comum e abundante em duas florestas inundadas distintas na Amazônia oriental, e se diferentes combinações de atributos funcionais estão relacionadas a diferentes níveis de nutrientes do solo e disponibilidade de luz nas florestas. Atributos funcionais dos indivíduos exibiram um trade-off crescimento versus persistência em cada floresta e maior variação de atributos entre indivíduos da espécie foi encontrado no igapó pobre em nutrientes. |
ABSTRACT: This study tested whether different functional strategies are formed between individuals of Macrolobium angustifolium (Benth.) R.S.Cowan, common tree species and abundant in two distinct flooded forests in eastern Amazonia, and whether different combinations of functional attributes are related to different levels of nutrients soil and light availability in the forests. Functional attributes of individuals exhibited a trade-off growth versus persistence in each forest and greater variation of attributes among individuals of the species was found in the nutrient-poor igapó. |
Um objetivo geral em ecologia das plantas é entender como os atributos funcionais variam entre as espécies e entre indivíduos e até que ponto essa variação tem valor adaptativo (Poorter et al., 2008). Atributos funcionais são características mensuráveis de um indivíduo (morfológicos, fisiológicos, fenológicos etc.) que podem aumentar o crescimento, sobrevivência, reprodução e fitness (valor adaptativo)direta ou indiretamente(Mcgill et al., 2006; Violle et al., 2007).
Os atributos funcionais estão relacionados à ocupação do nicho ecológico que alteram o desenvolvimento, reprodução e capacidade competitiva das espécies (Cianciaruso et al., 2009). E na teoria do nicho um fator importante para coexistência são os trade-offs ou compensações (Westoby et al., 2002) no uso dos recursos ou respostas diferenciais ao ambiente, ou seja, a vantagem de uma espécie sobre outra são contrabalançadas por desvantagens em outras funções (Tilman, 1982; Chesson, 2000).
As estratégias de plantas são usualmente relacionadas à combinação de características de plantas que melhor maximizam trade-offs na alocação de recursos para alcançar máximo crescimento, tamanho e idade, em diferentes combinações de disponibilidade de luz, água e nutrientes (Gillison, 2013). Podem ser quantificadas medindo características funcionais dos indivíduos, e quando são relacionados, podem mostrar uma dimensão de estratégia ecológica combinados com os trade-offs de investimentos (Westoby et al., 2002).
Indivíduos de uma mesma espécie podem desenvolver diferentes estratégias ecológicas dependendo das condições abióticas e da disponibilidade de recursos que se encontram (de Bello, 2006), e essa habilidade favorece a coexistência entre indivíduos. Essas estratégias em plantas podem variar desde estratégias mais conservativas com investimento em energia em longo prazo (folhas longevas, defesas estruturais, madeira mais densa etc.), até mais aquisitivas com investimentos em curto prazo (grandes folhas de vida curta, madeira menos densa, alta taxa fotossintética etc.) (Donovan et al., 2011). A combinação de diferentes atributos funcionais em um organismo pode definir a estratégia ecológica e assim também a distribuição do organismo num hábitat.
Variações dos atributos funcionais entre indivíduos da mesma espécie (variação intraespecífica) podem ser geradas por diferenças genéticas entre as populações ou por plasticidade fenotípica que é a capacidade do organismo mudar seu fenótipo sob uma determinada condição do ambiente (Jung et al., 2010). Espécies que apresentam grande variação intraespecífica podem ocupar uma maior variedade de ambientes, enquanto que uma espécie que tem baixa variação intraespecífica fica restrita a poucos locais, ou seja, são mais especializadas a um tipo de hábitat (Lavorel et al., 2007). Alguns trabalhos mostram que a variação intraespecífica aumenta as chances de indivíduos de uma espécie em adequarem seus atributos em resposta a um filtro ambiental ou competição com vizinhos, devido à plasticidade fenotípica (de Bello, 2006; Hulshof et al., 2013). Contudo, o impacto da plasticidade na coexistência das espécies merece uma quantificação robusta para se entender o real efeito (Turcotte & Levine, 2016).
Na Amazônia brasileira, algumas vegetações estão sujeitas à influência da inundação periódica e ocupam cerca 20% da região (Junk et al., 2010). Dois tipos são representativos e distintos quanto à estrutura, composição e riqueza de espécies: as florestas de várzea banhadas por rios de águas brancas ou barrentas ricas em sedimentos, caracterizadas pela alta fertilidade do solo, cobrindo uma área de 400 mil km2 (Melack & Hess, 2010), e as florestas de igapó banhadas por rios de água clara ou preta com baixo nível de nutrientes, pH ácido, e caracterizados pela baixa fertilidade do solo ocupando uma área de 180 mil km2 na bacia Amazônica (Junk et al., 2012).
A vegetação desses ambientes é adaptada para sobreviver durante longos períodos de estresse hídrico causado pelo alagamento (Furch & Junk, 1997; Ferreira, 2000). O gradiente de inundação é um fator importante para selecionar a ocorrência e distribuição de espécies, influenciando na diversidade da maioria das florestas inundadas (Wittmann, 2012). Devido a isto, a diversidade de características adaptativas em termos de estratégias do ciclo de vida e respostas ecofisiológicas à inundação periódica é notável em florestas alagadas, como o desenvolvimento de aerênquima, raízes adventícias e caules que permitem a difusão de oxigênio das partes aéreas da planta para as raízes, entre outras adaptações (Parolin, 2012).
Um padrão comumente encontrado nas florestas Amazônicas é a de que poucas espécies são abundantes e a maioria das espécies é representada por poucos indivíduos (Ter Steege et al., 2002; Matos et al., 2013). Este padrão também é encontrado em florestas inundadas sendo que algumas espécies de plantas são igualmente abundantes na várzea e no igapó, outras espécies tem maior abundância e domínio na várzea, e outras espécies tem maior domínio no igapó (Ferreira et al., 2013).
Este estudo testou a hipótese de que uma espécie comum e abundante em uma floresta de várzea e uma floresta de igapó localizadas na Amazônia brasileira desenvolve diferentes estratégias funcionais para se adaptar às diferentes condições ambientais de cada floresta inundada formando trade-offs, e estes estão relacionados às variações na quantidade de nutrientes no solo e disponibilidade de luz no sub-bosque o que permite a coexistência entre indivíduos da mesma espécie em cada floresta. As questões gerais deste estudo são: a) Existe diferença funcional entre as populações de uma espécie abundante e comum à várzea e ao igapó na Amazônia brasileira? Atributos funcionais da espécie comum e abundante na várzea e no igapó estão relacionados à disponibilidade de luz e nutrientes para a formação de trade-offs? A produção de biomassa da espécie está relacionada à formação de trade-offs no uso dos recursos em cada floresta?
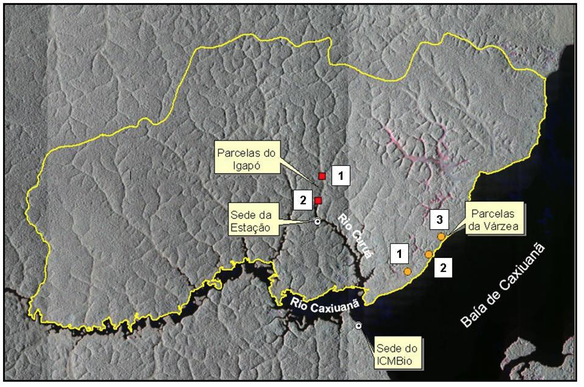
O estudo foi realizado na área da Estação Científica Ferreira Penna (ECFPn) localizada na (FLONA) Floresta Nacional de Caxiuanã, situada na mesorregião do Marajó, uma Unidade de Conservação de uso sustentável introduzida nos municípios de Portel e Melgaço, estado do Pará, Brasil, a cerca de 400 km a oeste da cidade de Belém (Figura 1).
A região de Caxiuanã tem o clima tipo Am, um clima tropical quente de acordo com a classificação de Köppen. A temperatura média anual é de cerca de 26,70° C, com mínima média de 23º C e máxima de 32,7º C. A umidade relativa do ar média é de 87%, sendo o relevo da região plano e ondulado, sem grandes elevações (Costa & Moraes, 2002).
Figura 1
Área da Estação Científica Ferreira Penna (linha em destaque), e localização das
parcelas permanentes (PELD) implantadas nas florestas inundadas de igapó e
de várzea adjacentes ao Rio Curuá e Baía de Caxiuanã, respectivamente.
As florestas inundadas da FLONA de Caxiuanã ocupam cerca 12% da área (Behling, 2011). Estão inseridas na classificação das áreas úmidas (UAs) costeiras onde o sistema hidrológico é classificado por existir um do pulso de inundação influenciado pelo regime de precipitação sazonal onde as amplitudes do pulso de inundação anual não são tão drásticas (cerca 1 a 1.5 metros) comparadas às planícies de inundação na Amazônia ocidental, e são mais influenciadas pelos movimentos de maré com variações diárias pequenas em torno de 30 cm no nível das águas (Hida et al., 1999; Junk et al., 2012). O período de enchente dos rios é entre os meses de janeiro a maio e o período de vazante ocorre entre maio e julho (Berredoet al., 2012).
A ECFPn apresenta floresta alagada de igapó banhada pelo Rio Curuá e floresta de várzea adjacente a Baía de Caxiuanã (Figura 1). O rio Curuá é um rio de água preta de baixo fluxo que apresenta altos níveis de matéria orgânica, pH ácido e área relativamente plana, conectado à Baía de Caxiuanã com cerca de 40 km de comprimento e 8-15 km de largura (Behling, 2011). A dinâmica da baía se assemelha a de um lago devido à sua curta profundidade, alta transparência e florações de fitoplâncton que reduzem a concentração de CO2 e aumentam o pH da água (Costa & Moraes, 2002). A baía foi criada através do represamento do rio Anapu, localizado ao norte da baía, o qual teve sua drenagem bloqueada por uma barragem natural causada pela deposição de sedimentos do rio Amazonas no final do Holoceno (Behling & da Costa, 2000). Não há conexão atual entre a Baía de Caxiuanã e o rio Amazonas que fica a cerca de 50 km a noroeste do local de estudo. Por isso, não são encontradas várzeas típicas em Caxiuanã, como as águas brancas ricas em sedimentos e nutrientes das várzeas do rio Amazonas, porque os rios locais apresentam menor teor de sedimentos (Costa & Moraes, 2002; Melo et al., 2013).
A zonação de espécies ao longo do gradiente de inundação periódico é evidente e comumente observada em florestas alagadas na Amazônia (Wittmann, 2012). Todavia, as florestas alagadas da ECFPn não exibem um zoneamento visível da vegetação, e são distintas em relação ao grau de cobertura do dossel e na densidade de plantas no sub-bosque. A floresta de igapó tem um dossel mais fechado e com grande densidade de plantas no sub-bosque, enquanto as florestas de várzea têm um dossel mais aberto e com pequena densidade de plantas no sub-bosque (Ferreira et al., 2012) (Figura 2).
A floresta de igapó é caracterizada pela maior riqueza de espécies em solos menos férteis e mais ácidos, classificados como gleissolos de textura siltosa (Piccinin & Ruivo, 2012), e a floresta de várzea com menor riqueza de espécies comparada ao igapó, porém é mais produtiva apresentando árvores com maior área basal em solos mais férteis classificados como plintossolos argilúvico (Ferreira et al., 2005; Piccinin & Ruivo, 2012).
Figura 2
Estrutura externa (A) e interna (B) da vegetação da floresta de igapó, e estrutura
externa (C) e interna (D) da floresta de várzea da Estação Científica Ferreira
Penna, Caxiuanã, Pará, Brasil.

As coletas foram realizadas em 32 parcelas de 10m x 10m (100 m2), sendo 16 parcelas distribuídas na floresta de várzea e 16 parcelas na floresta de igapó. As parcelas deste estudo foram estabelecidas próximas de parcelas permanentes de 1 ha2(100 x 100 metros) do Sítio PELD (Pesquisas Ecológicas de Longa Duração) para monitoramento da dinâmica das florestas alagadas na região de Caxiuanã. As parcelas PELD serviram somente como referência de localização e acessibilidade para implantar as parcelas deste estudo. Na floresta de igapó, as parcelas de 100m2 foram implantandas próximas a duas parcelas permanentes PELD, sendo 10 parcelas de 100 m2 distribuídas próximas a parcela permanente 1, e seis parcelas próximas a parcela permanente 2. Na floresta de várzea, as parcelas deste estudo foram distribuídas próximas a parcela 3 permanente PELD (Figura 1). Quando estabelecidas as parcelas todos os indivíduos arbóreos com diâmetro ≥ 5 cm foram identificados, e tiveram seus diâmetros a altura do peito (1,30 m do solo - DAP) medidos e altura máxima estimada.
Para este estudo selecionamos as populações de Macrolobium angustifolium (Benth.) R.S.Cowan, espécie de leguminosa abundante nas duas florestas.
Realizamos as coletas para medir os atributos funcionais das árvores em um período de baixa precipitação na região da FLONA de Caxiuanã em duas campanhas, a primeira em novembro/2015 e a segunda em janeiro/2016. Amostras de cinco folhas foram coletadas dos indivíduos das parcelas sem sinais visíveis de doenças fitossanitárias, depositadas em sacos de papel e armazenadas numa bolsa térmica para conservar a umidade das folhas.
A coleta das folhas das árvores muito altas foi feita de ramos que fossem alcançados por um podão de cerca 12 metros e com auxílio de uma escada de 5 metros de comprimento. Em todas as árvores procuramos coletar folhas maduras, expandidas e expostas ao sol de uma seção grande de galho localizada próximo ao ápice da copa. Porém, não foi possível coletar folhas de todas as árvores, pois a copa de algumas ultrapassava o alcance do podão. As folhas ainda frescas de cada amostra foram pesadas em uma balança de precisão mínima 0.001g para obtermos a massa úmida foliar. Logo em seguida, com as folhas ainda úmidas, foi medida a espessura foliar com auxílio de um micrômetro, e as folhas foram digitalizadas em scanner. As imagens digitalizadas foram usadas para medir a área foliar no Image J 1.46 (Schneider et al. 2012).
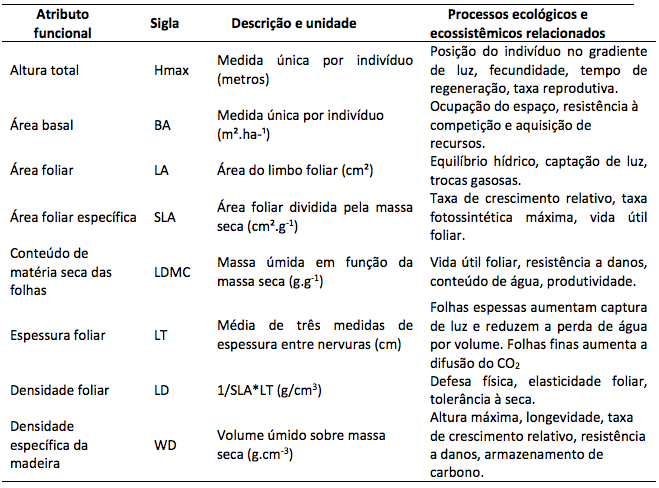
Ao final, medimos oito atributos funcionais que estão relacionados aos recursos do solo e a força competitiva segundo o protocolo de (Pérez-Harguindeguy et al. 2013), os quais são: altura máxima da planta (Hmax), área foliar específica (SLA), conteúdo de matéria seca das folhas (LDMC), espessura foliar (LT), densidade foliar (LD), e densidade específica da madeira (WD) (Tabela 1) (Tabela 1). A área basal (BA) de cada indivíduo foi obtida através da fórmula de Baker et al. (2004), onde Di é o diâmetro da árvore e n é o número de indivíduos por parcela:
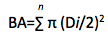
Coletamos amostras de solo em cinco pontos em cada parcela, quatro pontos distribuídos próximos de cada vértice das parcelas quadradas e um no centro da parcela. Em cada ponto, uma amostra de solo superficial de 20 cm de profundidade foi coletada com auxílio de uma pá, após remoção das folhas secas e de raízes grandes. As coletas individuais foram misturadas formando uma amostra composta por parcela e foram enviadas para a análise de fertilidade (fósforo [P], potássio [K], sódio [Na], cálcio [Ca], relação cálcio/magnésio [Ca+Mg], alumínio tóxico [Al], acidez potencial [H+Al] ), nitrogênio (N), micronutrientes (cobre [Cu], manganês [Mn], ferro [Fe], zinco [Zn] ), pH e granulometria (areia grossa, areia fina, silte e argila total) no Laboratório de Solos da EMBRAPA Amazônia Oriental/Belém-PA.
Uma fotografia hemisférica foi tirada a aproximadamente 1,65 m acima do nível solo no centro de cada parcela, e obtida através da câmera de um smartphone com lente olho de peixe (fisheye). As fotografias foram analisadas utilizando-se o aplicativo GLAMA- Gap Light Analysis Mobile App 3.0 (Tichý, 2016). Foi medida a abertura de dossel (CO – Canopy opennes) através da fração de área da fotografia hemisférica que não é obscurecida pelos elementos do dossel quando visto de um único ponto. A abertura de dossel é um indicador do potencial de penetração da radiação solar diariamente no sub-bosque da floresta, e de temperatura em um determinado ponto.
Tabela 1
Lista de atributos funcionais medidos, descrição e importância para os processos
ecológicos e ecossistêmicos que influenciam segundo Pérez-Harguindeguy et al. (2013).
As estimativas de biomassa acima do solo por indivíduo e parcela foram obtidas através da equação alométrica de Chave et al. (2005) para florestas úmidas, pois considera o diâmetro (DBH), a densidade da madeira (WD) e a altura (H), dado por:
Biomass = 0,0509* WD* DBH² *H
A densidade específica da madeira (WD) foi dada pelo volume úmido dividido pela massa seca (g.cm-3) de uma seção de galho com aproximadamente três centímetros de comprimento e de um a dois centímetros de largura coletado de todos os indivíduos nas parcelas. A seção de caule foi coletada dos mesmos galhos que usamos para coletar as folhas, entre à base do galho e a próxima ramificação. As seções de galho foram armazenadas em saco plástico para não perder umidade. O volume úmido das amostras de caules foi medido através do método de deslocamento de volume de água, devido à forma irregular dos galhos. Foi colocado um recipiente com água (200 ml) sobre uma balança de precisão, tarou-se a balança e com o auxílio de uma agulha, a amostra de caule foi totalmente submergida no recipiente com água. A massa de água deslocada corresponde ao volume úmido do caule (Chave, 2005). Em seguida, as amostras de folhas e caules foram secas em estufa a 70ᵒ C por 72 horas. As amostras secas foram pesadas para obtermos a massa seca em gramas de folhas e caules.
Para testar quais estratégias funcionais (aquisição ou conservação de recursos) são utilizadas pelos indivíduos de Macrolobium angustifolium nas duas florestas inundadas foi feita uma Análise de Componentes Principais (PCA) com os valores de atributos de cada indivíduo. Para analisar se trade-offs em investimentos são formados nas florestas inundadas foram feitas regressões simples para relacionar valores de atributos dos indivíduos, biomassa e variáveis ambientais (solo e abertura de dossel). Análise de Componentes Principais (PCA) com as variáveis do solo foi produzida para reduzir os dados do solo com menor perda possível das informações, e os eixos de maior variação resultantes foram relacionados às variáveis respostas (valores de atributos dos indivíduos e biomassa). Teste t foi utilizado para testar as diferenças entre valores de atributos funcionais das populações da espécie entre florestas inundadas através do Systat 12. Correlações de Pearson foram geradas para analisar as correlações entre atributos funcionais dos indivíduos de M. angustifolium em cada floresta.
Regressões e correlações foram feitas no software Systat 12, e as PCAs de atributos e variáveis do solo foram obtidas através do software PCORD (Multivariate Analysis of Ecological Data Version 6, https://www.pcord.com/pcordwin.htm).
Foram coletados atributos funcionais de 36 indivíduos de Macrolobium angustifolium (Benth.) R.S.Cowan na floresta de várzea e 34 indivíduos na floresta de igapó.
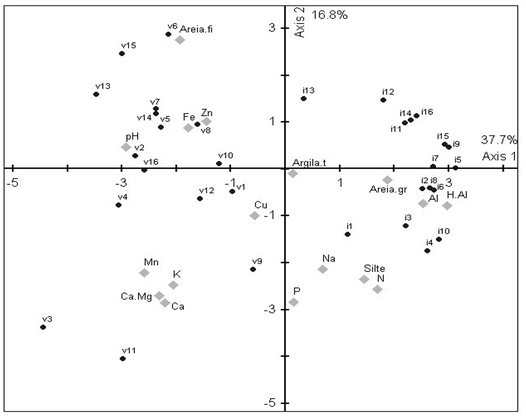
O eixo 1 da análise de ordenação (PCA) dos componentes do solo capturou 37.7% da variação total e descreveu um gradiente entre parcelas de igapó com alto teor de H+Al, Al, areia grossa, nitrogênio, silte, argila, Na e P, e parcelas de várzea com maior teor de Cu, Zn, Fe, areia fina, K, Ca, Ca+Mg, Mn e maior pH, mostrando uma clara separação entre as duas florestas em relação aos componentes do solo. O eixo 2 explicou 13.8% da variação e foi descrito por um gradiente com alto teor de areia fina, Zn, Fe e pH (lado positivo do eixo) e maior teor de argila, areia grossa e macronutrientes (lado negativo do eixo) (Figura 3).
Figura 3
Análise de Componentes principais gerada com os valores dos componentes químicos
e físicos do solo da floresta de várzea (v) e da floresta de igapó (i). O eixo
1 explicou 37.7% e mostrou uma clara separação entre floresta de várzea mais rica em
nutrientes e florestas de igapó mais pobre em nutrientes.
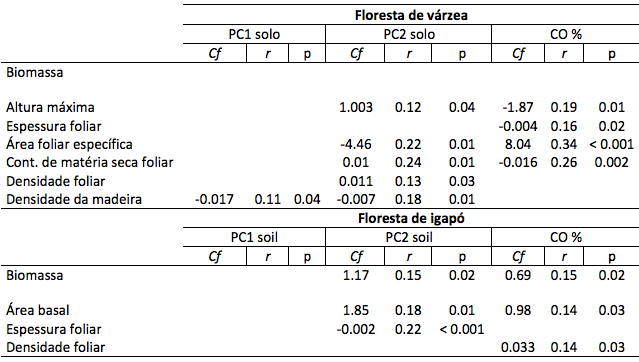
Na floresta de várzea, abertura de dossel (CO%) foi relacionada negativamente com a altura (Hmax), espessura foliar (LT) e conteúdo de matéria seca das folhas (LDMC), e positivamente à área foliar específica (SLA) na floresta de várzea (Tabela 2). A PC2 do solo foi relacionada positivamente com a altura máxima (Hmax), conteúdo de matéria seca foliar (LDMC) e densidade foliar (LD), e foi relacionada negativamente com área foliar específica (SLA) e densidade da madeira (WD) (Tabela 2).
Na floresta de igapó, área basal (BA) foi relacionada positivamente a abertura de dossel e a PC2 do solo. Houve uma relação negativa e significativa a PC2 do solo com a espessura foliar (LT). Densidade foliar (LD) foi relacionada positivamente com a abertura de dossel (CO%) (Tabela 2).
Não houve relação entre biomassa arbórea com as variáveis ambientais na floresta de várzea. Porém, a biomassa arbórea no igapó foi relacionada positivamente a abertura de dossel e a PC2 do solo. Parcelas com maior abertura de dossel e localizadas em solos menos ácidos e tóxicos tenderam a ter maior quantidade de biomassa arbórea (Tabela 2).
Área foliar específica (t= -3.403; P= 0.001), conteúdo de matéria seca nas folhas (t= -2.164; P= 0.03) e a densidade da madeira (t= 67.998; P= 0.03) foram significativamente maior na floresta de várzea (Figura 4c, 4d e 4e). Espessura foliar (t= 5.39; P < 0.001) e área foliar (t= 5.39; P < 0.001) foram significativamente maior na floresta de igapó (Figura 4a e 4b). Não houve diferenças significativas na altura total, área basal, densidade foliar e biomassa arbórea entre as florestas inundadas.
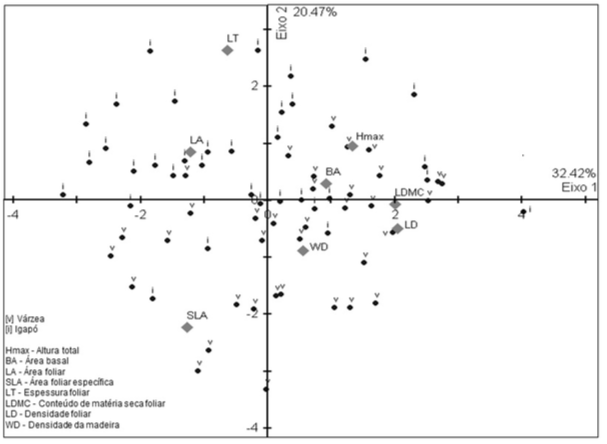
O eixo 1 da correlação produzida pela PCA com valores dos atributos funcionais dos indivíduos de M. angustifolium capturou 32.42% da variação e descreveu um gradiente de árvores na várzea e no igapó com maior área foliar específica (SLA), área foliar (LA) e espessura foliar (LT) (lado esquerdo do eixo 1), versus árvores com maior área basal (AB), altura (ALT), conteúdo de matéria seca foliar (LDMC), densidade foliar (LD) e densidade da madeira (lado direito do eixo 1) (Figura 4).
O eixo 2 da PCA dos atributos explicou 20.47% da variação total e mostrou uma separação quase total entre as duas florestas em relação aos atributos funcionais dos indivíduos. O lado positivo do eixo foi descrito por um gradiente formado por árvores de maioria do igapó com maior área foliar (LA) e espessura foliar (LT) (à esquerda) e maior área basal (BA) e altura (Hmax) (à direita). O lado negativo do eixo mostrou árvores da várzea com maior área foliar (SLA) (à esquerda) e maior conteúdo de matéria seca foliar (LDMC), densidade foliar (LD) e densidade da madeira (WD) (à direita) (Figura 4).
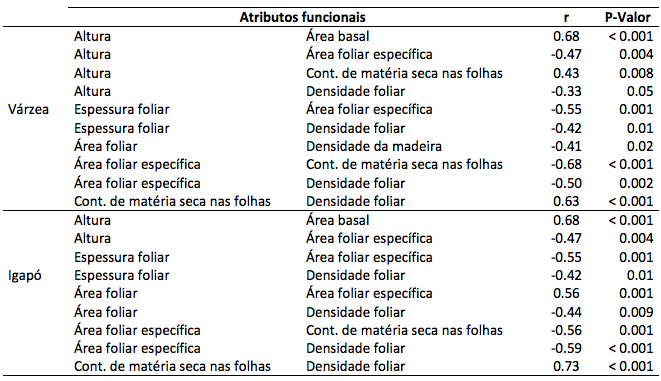
As correlações significativas entre atributos funcionais dos indivíduos de Macrolobium angustifolium amostrados na floresta de várzea e igapó estão mostradas na Tabela 3.
Figura 4
Análise de Componentes Principais gerada através de atributos funcionais dos
indivíduos de M. angustifolium da várzea (v) e igapó (i) na Floresta Nacional de Caxiuanã.
Primeiro eixo explicou 32.42% e o segundo eixo 20.47% da variação de atributos funcionais.
-----
Tabela 2
Coeficiente angular (Cf), relação (r2) e significância (p) resultantes das relações
entre biomassa e atributos dos indivíduos de Macrolobium angustifolium com
variáveis ambientais (Componentes principais do solo PC1 e PC2 e abertura de dossel)
na floresta de várzea e igapó deste estudo. Relações não significativas estão branco.
Nível de significância α≥ 0.05
-----
Tabela 3
Coeficiente de correlação de Pearson (r) e significância (P) entre valores de atributos
funcionais de indivíduos da espécie Macrolobium angustifolium (Benth) na
floresta de várzea e igapó.
O eixo 1 da PCA dos atributos funcionais exibiu um trade-off crescimento versus persistência entre indivíduos da espécie em cada floresta (Wright et al., 2004), que vai desde indivíduos com estratégias de maior crescimento e produtividade foliar (maior SLA e LA) até aqueles com estratégias de maior persistência, conservação de recursos, defesa estrutural e maior vida útil foliar devido apresentaram maiores valores de espessura foliar (LT), conteúdo de matéria seca foliar (LDMC), densidade foliar (LD) e densidade da madeira (WD).
Maior área foliar específica (área de captura de luz por unidade de massa seca) e área foliar (maior área para captura de luz) encontrada entre indivíduos de M. angustifolium na várzea e no igapó, respectivamente (à esquerda do eixo 1 da PCA), aponta para uma estratégia de rápido crescimento por causa de uma maior capacidade fotossintética líquida associada a uma maior área de exposição das folhas à luz e que predomina em ambientes com maior disponibilidade de recursos (Westoby, 1998; Westoby et al., 2002). Contudo, os indivíduos de M. angustifolium na floresta de igapó em geral têm menor SLA do que os indivíduos na várzea apontando para uma estratégia com vantagens em longo prazo (Reich et al., 1999) (Figura 4c). Espécies com menor SLA apresentam lâminas foliares mais espessas, com menor concentração de nitrogênio, vasos mais salientes, maiores densidade de tecidos ou combinações destes, tende a ter uma vida útil da folha mais longa em vários habitats devido apresentar força estrutural extra com a alocação às vezes de taninos, fenóis ou outros compostos defensivos (Westoby et al., 2002) .
Apesar dos indivíduos da espécie apresentar em geral uma estratégia aquisitiva versus conservativa, a combinação de atributos para a formação das estratégias de crescimento e conservação, e as relações deles com as variáveis ambientais foram bem distintas em cada floresta. O segundo eixo da PCA dos atributos funcionais mostrou um trade-off secundário, não menos importante, entre produtividade foliar e tamanho da folha (lado esquerdo do eixo). Na floresta de várzea indivíduos com maior SLA, ou seja, com maior produtividade foliar, tendem a possuir folhas menores do que os indivíduos do igapó, menor altura e área basal em áreas com maior abertura do dossel, em solos com maior teor Ca, Ca+Mg, Mn e K (macronutrientes). Na floresta de igapó indivíduos com maior SLA (porém, menor SLA comparado à várzea) apresentam folhas maiores, menor altura e área basal, em áreas mais fechadas da floresta e em solo menos ácido e tóxico (menor teor de Al e H+AL e areia grossa) com maior disponibilidade de micronutrientes como Fe e Zn. Espécies ou indivíduos com estratégias aquisitivas estão normalmente associadas a maior utilização de recursos e são mais bem sucedidos em habitats ou locais com maior disponibilidade de luz, água ou nutrientes (Fonseca et al., 2000; Ackerly et al., 2002; Sterck et al., 2011).
Na floresta de várzea, pequenas folhas com alta área foliar específica estão associadas a indivíduos de baixa estatura em áreas com maior abertura de dossel, sugerindo uma estratégia de crescimento em local com maior intensidade luminosa, a qual seleciona pequenas folhas por apresentarem menor área para captura de luz e maior resfriamento convectivo para evitar a perda de água (Poorter & Rozendaal, 2008). Além disso, folhas menores foram relacionadas à maior densidade da madeira na várzea. O tamanho da folha pode diminuir com o aumento da densidade da madeira, e esta relação se deve a questão hidráulica. Folhas pequenas demandam de menos seiva e maior densidade da madeira daria maior resistência à cavitação do xilema, e as folhas mostrariam maiores flutuações no potencial de água interno (Wright et al., 2007).
Na floresta de igapó, grandes folhas com maior área foliar específica estão relacionadas a indivíduos de baixa estatura em locais mais fechados do dossel (menor penetração de radiação solar no sub-bosque), sugerindo uma estratégia de maior aquisição de luz para fotossíntese em local sombreado (Turner, 2001), podendo ser pequenas árvores juvenis aguardando maior disponibilidade de luz e uma oportunidade para crescer e chegar ao dossel (Poorter et al., 2006).
O lado direito do eixo 2 da PCA de atributos funcionais forma um trade-off de atributos conservativos para estoque de biomassa acima do solo, isto significa que o maior acúmulo de biomassa nas duas florestas está relacionado às estratégias conservativas. A demanda por recursos pela espécie e as relações entre atributos conservativos para estoque de biomassa foi distinto dentro de cada floresta inundada. Na floresta de várzea, caracterizada por solo mais fértil e menos ácido, maior quantidade de biomassa esteve relacionada a indivíduos altos, menor SLA e maior conteúdo de matéria seca (LDMC) e densidade foliar (LD) em locais um pouco mais restritivos na disponibilidade de luz e macronutrientes. Espécies ou indivíduos com estratégias conservativas estão voltados para maior conservação de recursos para sobreviver por mais tempo, possuem maior tolerância à sombra ou a seca e são bem sucedidos em habitats com maior restrição de recursos (Sterck et al., 2006; Sterck et al., 2011).
No igapó o maior estoque de biomassa arbórea ocorreu em indivíduos com menor SLA, maiores LD e LDMC, de grande estatura e área basal, em locais onde a demanda de recursos como luz e nutrientes foi maior, sugerindo uma estratégia conservativa de acúmulo de biomassa em ambientes pobre em nutrientes. Espécies ou indivíduos conservativos com maior área basal, LDMC e menor SLA podem acumular mais carbono em florestas (Shen et al., 2016), e área de matéria foliar (ou LMA que é 1/SLA) pode ser alta quando a taxa de fotossíntese é mais rápida em locais com altas reservas de luz e CO2 (Poorter et al., 2009). Menor SLA acompanhada do aumento da idade da planta pode causar uma acumulação de substâncias ricas em carbono, possivelmente refletindo espessamento e melhora da lignificação de paredes celulares e um aumento geral de densidade foliar (Niinemets, 2007, Poorter et al., 2009).
Na floresta de igapó, representada por solos mais ácidos e pobres em nutrientes, as relações entre atributos funcionais e variáveis ambientais foram mais complexas evidenciando uma diferenciação funcional das populações de M. angustifolium para utilizar os recursos limitados nesse ambiente (Lambers et al., 2010). Segundo as relações entre atributos, variáveis ambientais e biomassa arbórea na floresta de igapó foram obtidas as seguintes combinações: (a) áreas mais abertas em solos menos tóxicos e ácidos (menor teor de Al e H+AL e areia grossa) tendem apresentar indivíduos com maior área basal, biomassa, altura, conteúdo de matéria foliar e densidade foliar, e menor área foliar específica e espessura foliar; (b) áreas mais abertas em solos mais tóxicos e ácidos (maior teor de Al e H+AL e areia grossa) tendem a possuir árvores com maior conteúdo de matéria foliar e densidade foliar, e menor área foliar específica, espessura foliar e biomassa arbórea; e (c) áreas com dossel mais fechado em solo mais tóxico e ácido tendem a ter indivíduos com maior espessura foliar e menor área foliar específica, área basal, biomassa, densidade foliar e conteúdo de matéria foliar.
Existe uma hipótese de que espécies aquisitivas em recursos expressam uma maior magnitude de respostas intraespecíficas do que espécies conservativas, porque geralmente parecem melhores para explorar diferentes níveis de disponibilidade de recursos (Grassein et al., 2010). Porém, Freschet et al. (2010) sugerem que a capacidade de grande variação intraespecífica em atributos pode ser igualmente importante tanto para as espécies aquisitivas quanto para as conservativas. Em ambientes com solos pobres em nutrientes ou mais antigos, plantas podem exibir diferentes estratégias de absorção e utilização de nutrientes, promovendo uma maior diferenciação de nichos funcionais permitindo que mais espécies e indivíduos coexistam (Lambers et al., 2010). A heterogeneidade ambiental é generalizada tanto em locais férteis e não férteis e as plantas características de ambos os ambientes podem ter um benefício seletivo através da exibição de fortes respostas de atributos intraespecíficos (Freschet et al., 2010).
O padrão funcional das populações de Macrolobium angustifolium variou entre florestas inundadas e exibiu um trade-off crescimento e produtividade foliar versus persistência e vida útil entre indivíduos na várzea e no igapó. Porém, as relações de atributos funcionais na formação de estratégias aquisitivas e conservativas foram distintas, devido às diferenças ambientais e à variação espacial na disponibilidade de luz e nutrientes em cada floresta.
Indivíduos de M. angustifolium exibiram estratégias aquisitivas e conservativas com diferentes combinações de atributos em cada floresta, mostrando que esta espécie possui alta plasticidade fenotípica em resposta a diferentes níveis de recursos em florestas alagadas, por isso ela é abundante nesses sistemas. A espécie também exibiu maior diferenciação de estratégias ou plasticidade funcional para ocupação espacial e alocação de biomassa acima do solo na floresta de igapó apesar desta ser um ambiente pobre em nutrientes no solo e mais restritivo em recursos.
Estudos sobre estratégias funcionais de plantas em florestas alagadas ainda são poucos, e grande parte da variação de estratégias das espécies para obter ganho ou conservação de carbono em florestas inundadas não são conhecidas. Estudos com maior número de espécies são necessários para responder se a magnitude das respostas intraespecíficas das plantas se relaciona com sua economia de recursos.
Ackerly, D. D., Knight, C., Weiss, S., Barton, K., Starmer K. (2002). Leaf size, specific leaf area and microhabitat distribution of chaparral woody plants: contrasting patterns in species level and community level analyses. Oecologia, 130, 449-457.
Baker, T. R. et al. 2004. Increasing biomass in Amazonian forest plots. Philosophical Transactions of the Royal Society of London, 359,353-365.
Behling, H. G. (2011). Holocene environmental dynamics in coastal, eastern and central Amazonia and the role of the Atlantic sea-level change. Geographica Helvetica, 66, 208-216. 2011.
Behling, H. G., da Costa, M. L. (2000). Holocene Environmental Changes from the Rio Curuá Record in the Caxiuanã Region, Eastern Amazon Basin. Quaternary Research, 53, 369–377.
Berredo, J.F., Melo, D.M.B., Ribeiro, M.M., Migiyama, A.C., y Sales, M.E. (2012). Hidrografia da Floresta Nacional de Caxiuanã. In: Instituto Chico Mendes de Conservação da Biodiversidade Editor (ed.), Plano de Manejo da Floresta Nacional de Caxiuanã (pp. 128-132). Brasília: ICMBio.
Cianciaruso, M.V., Silva, I. A., Batalha, M. A. (2009). Phylogenetic and functional diversities: new approaches to community Ecology. Biota Neotropica, 9(3): 93-103.
Chave, J. (2005). Wood Density measurement Protocol. Measuring wood density for tropical forest trees. A field manual for the CTFS sites. Recuperado de http:// http://chave.ups-tlse.fr/chave/wood-density-protocol.pdf.
Chave, J., Andalo, C., Brown, S., Cairns, M. A., Chambers, J. Q., Eamus, D., Fölster, H., Fromard, F., Higuchi, N., Kira, T. et al. (2005). Tree allometry and improved estimation of carbon stocks and balance in tropical forests. Oecologia, 145, 87-99.
Chesson, P. (2000). Mechanisms of maintenance of species diversity. Annual Review of Ecology, Evolution and Systematics, 31, 343-366.
Costa, J.P.R., Moraes, J.C. (2002). Médias mensais de variáveis metereológicas. In: Lisboa, P. L. B. Organizador (Org.), Caxiuanã: (p.p. 225-232). Belém: Museu Paraense Emílio Goeldi.
de Bello, F., Leps, J. A. N., Sebastia, M. T. (2006). Variations in species and functional plant diversity along climatic and grazing gradients. Ecography,29, 801-810.
Donovan, L. A. et al. 2011. The evolution of the worldwide leaf economics spectrum. Trends in Ecology and Evolution, 26, 88-95.
Ferreira, L.V., Almeida, S. S., Amaral, D.D., Parolin, P. (2005). Riqueza e Composição de Espécies da Floresta de Igapó e Várzea da Estação Científica Ferreira Pena: Subsídios para o plano de Manejo da Floresta Nacional de Caxiuanã. Pesquisas, Botânica, (56), 103-116.
FERREIRA, L. V., CHAVES, P. P., CUNHA, D. A., MATOS, D. C. L., PAROLIN, P. (2013). Variação da riqueza e composição de espécies da comunidade de plantas entre as florestas de igapós e várzeas na Estação Científica Ferreira Penna-Caxiuanã na Amazônia oriental. Pesquisas, Botânica, (64), 175-195.
FERREIRA, L.V et al. (2012) Fatores bióticos. Vegetação. In: ICMBIO. Plano de Manejo da Floresta Nacional de Caxiuanã, Volume 1 (p.p. 128-132). Recuperado em http://www.icmbio.gov.br/portal/unidadesdeconservacao/biomas-brasileiros/amazonia/unidades-de-conservacao-amazonia/1928-flona-de-caxiuana?highlight=WyJjYXhpdWFuXHUwMGUzIl0
Fonseca, C. R., Overton, J. M., Collins, B., Westoby, M. (2000). Shifts in trait-combinations along rainfall and phosphorus gradients. Journal of Ecology, 88, 964-77.
Freschet, G. T., et al. (2013). Plasticity in above- and belowground resource acquisition traits in response to single and multiple environmental factors in three tree species. Ecology and Evolution, 3(4), 1065-1078.
Grassein, F., Till-Bottraud, I., Lavorel, S. (2010). Plant resource-use strategies: the importance of phenotypic plasticity in response to a productivity gradient for two subalpine species. Annals Botany, 106, 637-645.
Gillison, A. N. (2013). Plant functional types and traits at the community, ecosystem and world level. In: Van der Maarel, E., Franklin, J. Vegetation Ecology, (p.p. 347-386). Wiley BlackWell.
Hida, N., Maia, J. G., Hiraoka, M., Shimm, O., Nobuaki, M. (1999). River water level changes of the Amazon Estuary: at Breves, Caxiuanã and Abaetetuba. Hydrological and Geochemical Processess in Large Scale River Basins, 1-9.
Hulshof, C. (2013). Intra-specific and inter-specific variation in specific leaf area reveal the importance of abiotic and biotic drivers of species diversity across elevation and latitude. Journal of Vegetation Science, 24, 921-931.
Jung, V. et al. (2010). Intraspecific variability and trait based community assembly. Journal of Ecology, 98, 1134-1140.
Junk W. J., Piedade, M.T.F, Schöngart, J., Wittmann, F. (2012). A classification of major natural habitats of Amazonian whitewater river floodplains (várzeas). Wetlands Ecology and Management, 20, 461-475.
Junk, W. J., Piedade, M. T. F., Wittmann, F., Schöngart, J., Parolin, P. (2010). Central Amazonian Floodplain forests: ecophysiology, biodiversity and sustainable management. Ecological Studies 210.
Lambers, H., Brundrett, M. C., Raven, J. A., Hopper, S. D. (2010). Plant mineral nutrition in ancient landscapes: high plant species diversity on infertile soils is linked to functional diversity for nutritional strategies. Plant and Soil, 334, 11–31.
Lavorel, S. et al. (2007). Plant functional types: are we getting any closer to the holy grail? 2007. In: Canadell, J. G. Editor, Pitelka, L. Editor (eds.), Terrestrial ecosystems in a changing world (p.p. 149-160). Berlin: Springer-Verlag.
Matos, D. C. L, Ferreira, L.V., Salomão, R. P. (2013). Influência da distância geográfica na riqueza e composição de espécies arbóreas em uma Floresta Ombrófila Densa na Amazônia Oriental. Rodriguésia, 64(2), 357-367.
Mcgill, B. J., Enquist, B. J., Weiher, E., Westoby, M. (2006). Rebuilding community ecology from functional traits. Trends in Ecology & Evolution, 21, 178-185.
Melack, J. M., Hess, L. L. (2010). Remote sensing of the distribution and extent of wetlands in the Amazon basin. In: Junk, W. J. Editor, Piedade, M. T. F. Editor, Wittmann, F. Editor, Schongart, J. Editor, Parolin, P. Editor (eds.), Ecology and management of Amazonian floodplain forests Ecological studies (p.p. 43-59). Berlin: Springer.
Melo, D. M. B. et al. (2013). Aspectos físico-químicos dos ambientes fluviolacustres de Caxiuanã. In: Lisboa, P. L. B. Organizador (org.), Caxiuanã: paraíso ainda preservado (p.p. 91-103). Belém: Museu Paraense Emílio Goeldi.
Niinemets, Ü. (2007). Photosynthesis and resource distribution through plant canopies. Plant, Cell & Environment, 30, 1052-1071.
Parolin, P. (2012). Diversity of adaptations to flooding in trees of Amazonian floodplains. Pesquisas Botânica, 63, 7-28.
Pérez-Harguindeguy, N. et al. (2013). New handbook for standardised measurement of plant functional traits worldwide. Australian Journal of Botany, 61 (3), 167-234.
Piccinin, J., Ruivo, M. L. (2012). Os solos da Floresta Nacional de Caxiuanã. In: Instituto Chico Mendes de Conservação da Biodiversidade Editor (ed), Plano de Manejo da Floresta Nacional de Caxiuanã (p.p. 120-127). Brasília: ICMBio.
Poorter, L., Bongers, L., Bongers, F. (2006). Architecture of 54 moist-forest tree species: traits, trade-offs, and functional groups. Ecology, 87, 1289-1301.
Poorter, L. et al. (2008). Are functional traits good predictors of demographic rates? Evidence from five neotropical forests. Ecology, 89, 1908-1920.
Poorter, L., Rozendaal, D. M. A. (2008). Leaf size and leaf display of thirty-eight tropical tree species. Oecologia, 158, 35-46.
Poorter H., Niinemets Ü., Poorter L., Wright I.J., Villar R. (2009). Causes and consequences of variation in leaf mass per area (LMA): a meta-analysis. New Phytologist, 182, 565-588.
Reich, P. B. et al. (1999). Generality of leaf trait relationships: a test across six biomes. Ecology, 80, 1955-1969.
Shen, Y., Yu, S., Lian, J., Shen, H., Cao, H., Lu, H., Ye, W. (2016) Tree aboveground carbon storage correlates with environmental gradients and functional diversity in a tropical forest. Scientific Reports, 6, 1-10.
Schneider, C. A, Rasband, W. S., Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 years of image analysis. Nature Methods, 9 (7), 671-675.
Sterck, F. (2011). Functional traits determine trade-offs and niches in a tropical forest community. PNAS, 108 (5), 20627-20632.
Sterck, F. J., Poorter, L., Schieving, F. (2006). Leaf traits determine the growth-survival trade-off across rain forest tree species. American Naturalist, 167, 758-765.
Ter Steege, H. et al. (2003). A spatial model of tree a-diversity and tree density for the Amazon. Biodiversity and Conservation, 12, 2255-2277.
Tichý, L. (2015). Field test of canopy cover estimation by hemispherical photographs taken with a smartphone. Journal of Vegetation Science, 27(2), 427-435.
Tilman, D. (1982). Resource Competition and Community Structure. Princeton University Press: Princeton.
Turner, I. M. (2001). The ecology of trees in the tropical rain forest. Cambridge University Press: Cambridge.
Turcotte, M. M., Levine, J. M. (2016). Phenotypic Plasticity and Species Coexistence. Trends in Ecology & Evolution, 31(10), 803-813.
Violle, C. et al. (2007). Let the concept of trait be functional! Oikos, 116, 882-892.
Westoby, M. (1998). A leaf–height–seed (LHS) plant ecology strategy scheme. Plant and Soil, 199, 213-227.
Westoby, M., Falster, D., Moles, A., Vesk, P., Wright, I. (2002). Plant ecological strategies: some leading dimensions of variation between species. Annual Review of Ecology and Systematics, 33: 125-59.
Wright, I. J. (2007). Relationships among major dimensions of plant trait variation in seven Neotropical forests. Annals of Botany, 99, 1003-1015.
Wright, I. J. et al. (2004). The world-wide leaf economics spectrum. Nature, 428, 821-827.
Wittmann, F. (2012). Tree species composition and diversity in Brazilian freshwater floodplains. In: Pagano, M. C. Editor (ed), Mycorrhiza: Occurrence in Natural and Restored Environments (p.p. 223-263). New York: Nova Science Publishers.
1. Coordenação de Botância. Museu Paraense Emílio Goeldi. Email: dcleal_eco@yahoo.com.br
2. Coordenação de Botância. Museu Paraense Emílio Goeldi. Email: lvferreira@museu-goeldi.br
3. Departamento de Botânica, Setor de Ciências Biológicas. Universidade Federal do Paraná. Email: marcos.carlucci@gmail.com